
����Ŀ����ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��100 g 5.00%��NaOH��Һ��������CuSO4��Һ��100 g 10.00%��K2SO4��Һ���缫��Ϊʯī�缫��

(1)��ͨ��Դ������һ��ʱ���ñ���K2SO4Ũ��Ϊ10.47%������c�缫�������ӡ��ݴ˻ش����⣺
����Դ��N��Ϊ____________________����
���缫b�Ϸ����ĵ缫��ӦΪ____________________��
����ʽ����缫b�����ɵ������ڱ�״���µ������________________��
���缫c�������仯��__________g��
�����ǰ�����Һ���ᡢ���Դ�С�Ƿ����仯��������ԭ����Һ______________________________������Һ______________________________������Һ______________________________��
(2)�����������ͭȫ����������ʱ����ܷ�������У�Ϊʲô�� ________________________________________��
���𰸡� �� 4OH����4e��===2H2O��O2�� ˮ���ٵ�������100g��(1��![]() )��4.5g ����O2�����
)��4.5g ����O2����� ![]() ��
��![]() ��22.4L��mol-1=2.8L 16 ����������Ϊ����ˮ�����٣���Һ��NaOHŨ������ ����������Ϊ������OH������O2����Һ��H������Ũ������ ����Դ�Сû�б仯����ΪK2SO4��ǿ��ǿ���Σ�Ũ�����Ӳ�Ӱ����Һ������� �ܼ������У���ΪCuSO4��Һ��ת��ΪH2SO4��Һ����ӦҲ�ͱ�Ϊˮ�ĵ�ⷴӦ
��22.4L��mol-1=2.8L 16 ����������Ϊ����ˮ�����٣���Һ��NaOHŨ������ ����������Ϊ������OH������O2����Һ��H������Ũ������ ����Դ�Сû�б仯����ΪK2SO4��ǿ��ǿ���Σ�Ũ�����Ӳ�Ӱ����Һ������� �ܼ������У���ΪCuSO4��Һ��ת��ΪH2SO4��Һ����ӦҲ�ͱ�Ϊˮ�ĵ�ⷴӦ
��������(1)���ұ���c�������ӣ�˵��Cu������c�缫�ϣ������Ǵ�b-c�ƶ���M�Ǹ�����NΪ������
������ΪNaOH���൱�ڵ��H2O������b��Ϊ������OH-�ŵ磬��4OH--4e-=2H2O+O2����
������ΪK2SO4���൱�ڵ��ˮ�������ˮ������Ϊx���ɵ��ǰ��������������У�100��10%=(100-x)��10.47%����x=4.5g����Ϊ0.25mol���ɷ���ʽ2H2+O2�T2H2O��֪������2molH2O��ת��4mol���ӣ�����������Ӧ��ת��0.5mol���ӣ�������O2Ϊ0.5/4=0.125mol������µ����Ϊ0.125��22.4=2.8L��
��������·�Ǵ����ģ�����ÿ���ձ��еĵ缫��ת�Ƶ���������ȵģ����ݵ缫��Ӧ��Cu2++2e-=Cu����֪ת��0.5mol�������ɵ�m(Cu)= ![]() ��64=16g��
��64=16g��
�������൱�ڵ��ˮ����NaOH��Ũ������pH�����������ΪCu2+�ŵ磬����ΪOH-�ŵ磬��ⷽ��ʽΪ��2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4������H+���࣬��pH��С������Ϊ���ˮ������K2SO4���ԣ���pH�������䣻
2Cu+O2��+2H2SO4������H+���࣬��pH��С������Ϊ���ˮ������K2SO4���ԣ���pH�������䣻
(2)��ͭȫ������ʱ����Һ�����е�������ᣬ���Լ�����⣬�ʴ�Ϊ�����ԣ� ͭȫ�����������Լ������H2SO4���е��Һ���ɵ�⡣


 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����Ȳ��ȡ��˵������ȷ����
A. ��Ӧ����Һ�ʼ���
B. �˷�Ӧ�Ƿ��ȷ�Ӧ
C. Ϊ�˳�ȥ�������壬��������ͭ��Һ
D. Ϊ�˼ӿ췴Ӧ���ʿ��ñ���ʳ��ˮ����ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȡ�������ۣ���һ�ݼ���������NaOH��Һ���ڶ��ݼ������������ᣬ���ų��������������ȣ�ͬ��ͬѹ�������������۵�������Ϊ��������
A. 1��2 B. 1��3 C. 3��2 D. 1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������У�ͬ���칹����Ŀ����7�����У� ��
A.����
B.��ϩ
C.1��2���������
D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������ͬŨ�ȵĴ���������зֱ����NaOH��Һ����pH������NaOH��Һ������仯��ϵ�ֱ�����ͼI��II��ʾ�������£���xmol/L�������VmLymol/L�ļ���Һ�У���ҺpH���¶��������������仯��������ͼIII��ʾ��
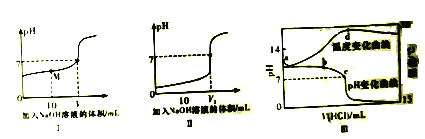
����˵����ȷ����
A. �ü���Һ������Ba(OH)2��Һ
B. c��d�����Ӧ�����������ͬ
C. ��ͼ�п��ж�xԼΪ1, yС��1
D. d����¶Ƚ��ͣ�����Ϊ���ɵ��η���ˮ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȷ£�CHCl3 �� �ǵ���ʣ��ڿ������ܷ����������������ɾ綾���ʹ�����COCl2 �� �ǵ���ʣ�����ѧ����ʽΪ2CHCl3+O2=2COCl2+2HCl�������ȷ��Ƿ�����Ӧѡ�õ��Լ��ǣ�������
A.ˮ
B.NaOH��Һ
C.��̪��Һ
D.�����ữ����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ѧϰ��ѧ����Ҫ���ߣ����л�ѧ�����У���ȷ����
A. NH4+��ˮ�ⷴӦ���ӷ���ʽ��NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
B. ��AgCl����Һ�м���KI��Һ�����Ag++I-=AgI��
C. ��ͭʱ�������ĵ缫��ӦʽΪ��Cu2++2e-�TCu
D. ij��Ӧ��H��0����÷�Ӧ�����������¾����Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.���ⶨ�Ҵ��Ļ�ѧʽ��C2H6O�������л����ձ����ͬ���칹�����Ʋ��Ҵ��Ľṹ��������������֮һ��

Ϊ�ⶨ��ṹ��Ӧ�������ʵ������Խ��ж��ԡ�����ʵ�顣�ָ����Ҵ����ơ�ˮ����Ҫ����������ס��ҡ�������4λͬѧ��������ͼ��װ�ý���ʵ�飬ȷ���Ҵ��Ľṹ��

(1)ͬѧ�õ�һ��ʵ�����������
�Ҵ������ʵ���/mol | ���������/L |
0.10 | 1.12(��״��) |
�������������ƶ��Ҵ��ĽṹΪ______(�â��ʾ)������Ϊ____________��
(2)ͬѧ�ҷֱ�ȷ����4.60 g�Ҵ����ж��ʵ�飬���������������Ͳ��ˮ�������Ϊ���ɵ�H2���������ɱ�״����С��1.12 L�����������Ͳ��������ͬѧ������ɵ�����ͬѧ��Ϊ������������Ʒ�к�������ˮ��ɵģ�����Ϊ��ȷ��?______(���ȷ������ȷ��)����˵������__________________________________________________________________��
(3)ͬѧ����Ϊʵ��ɹ��Ĺؼ��У���װ��������Ҫ���ã���ʵ�鿪ʼǰȷȷ���Ҵ������������������ܹ��ƿ��ˮ�������������������IJ��㷽����ȷ������ȷ�����У���ȷ����_________________(�����)��
(4)ͬѧ������ͨ�������Ҵ���������ȷ���Ҵ���������ô����Ҫ֪����������________��
(5)ʵ���4��ͬѧ���Ҵ��Ŀ��ܽṹ�������֣����Ҵ����Ƶ����Ĺ�ϵ���������ۣ�����Ҵ������ʵ���Ϊn mol����ô���Ƶ����ʵ�����ȡֵҪ������____________��
II����֪A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ������AΪ��Ҫԭ�Ϻϳ�һ�־��й���ζ������E����ϳ�·������ͼ��ʾ��

��ش��������⣺
��1��A�Ľṹ��ʽΪ______________________����ũҵ�Ͽ�������________________��
��2��E�Ľṹ��ʽΪ___________________��B��D����������Ʒ�Ӧ�Ļ�ѧ����ʽΪ____________________________��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����0.50 mol/L NaOH��Һ��0.50 mol/L������Һ�����к��ȵIJⶨ��
������0.50 mol/L NaOH��Һ
��ʵ���д�ԼҪʹ��245 mL NaOH��Һ��������Ҫ����NaOH����_____g��
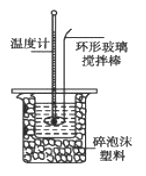
�ⶨϡ�����ϡ���������к��ȵ�ʵ��װ����ͼ��ʾ��
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ���к���Ϊ57.3 kJ/mol����_____________��
��2��ȡ50 mL NaOH��Һ��30 mL������Һ����ʵ�飬ʵ���������±���
������д�±��еĿհף�
��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ�ƽ��ֵ ��t2-t1��/�� | |||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | ||
�ڽ�����Ϊ0.50 mol/L NaOH��Һ��0.50 mol/L������Һ���ܶȶ���1 g/cm3���кͺ�������Һ�ı�����c=4.18 J/(g�����������к��ȡ�H=______________ȡС�����һλ����
������ʵ����ֵ�����57.3 kJ/mol��ƫ�����ƫ���ԭ������ǣ�______��
A��ʵ��װ�ñ��¡�����Ч����
B����ȡNaOH��Һ�����ʱ���Ӷ���
C���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
D�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com