
【题目】碘元素在下列物质中以单质存在的是
A. 碘酒 B. 海带 C. 含碘食盐 D. 人工降雨剂
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1mol X分解得到A、B、C各1mol. 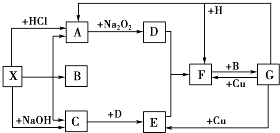
试回答下列各题:
(1)写出下列物质的化学式:X , B .
(2)写出下列反应的化学方程式: ①H+G﹣→A+F: .
②C+D﹣→E: .
(3)写出下列反应的离子方程式: G+Cu﹣→E: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:T℃、P kpa时,容积为V 的密闭容器中充有1molA和2molB,保持恒温恒压使反应达平衡:A(g)+B(g)![]() C(g),平衡时C 的体积分数为40℅。
C(g),平衡时C 的体积分数为40℅。
(1)欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为___________,C的体积分数为______________。
(2)另取一个容积固定不变的密闭容器,仍控制温度为T℃,加入1molB和1molC,要使平衡时C 的体积分数仍为40℅,则该密闭容器体积为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表.此电池 的负极是 , 电极反应式为;正极的电极反应式为 .
(2)一切化学反应除了有质量的变化外,还伴随着的变化,能量变化通常主要表现为的变化,即或者 .
(3)可逆反应2SO2+O22SO3 , 如果SO2的起始浓度为2molL﹣1 , 2min后SO2的浓度为1.8molL﹣1 , 则用SO2的浓度变化表示的反应速率为: , 用O2的浓度变化表示的反应速率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子数比A元素原子核外电子总数多5个,则A,B两元素形成的化合物可表示为( )
A.BA2
B.BA3
C.A3B2
D.B3A2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如图:
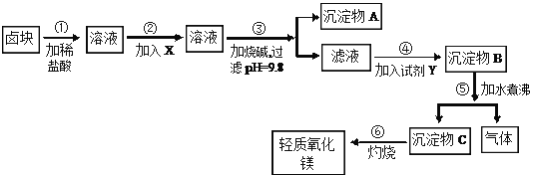
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH | 表2 化学试剂价格表 | ||||
物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
Fe(OH)3 | 2.7 | 3.7 | 漂液(含25.2% NaClO) | 450 | |
Fe(OH)2 | 7.6 | 9.6 | 双氧水(含30% H2O2) | 2400 | |
Mn(OH)2 | 8.3 | 9.8 | 烧碱(含98% NaOH) | 2100 | |
Mg(OH)2 | 10.0 | 11.1 | 纯碱(含99.5% Na2CO3) | 600 | |
(1)在步骤②中加入的试剂X(从表2中选择)是_______而不是双氧水,其原因是_______________________。写出加入X发生反应的离子方程式_______________________。
(2)在步骤③中控制pH=9.8,其目的是____________________________。
(3)沉淀物A的成分为______________,试剂Y(从表2中选择)应该是_______。
(4)在步骤⑤中发生反应的化学方程式是________________________。
(5)若在实验室中完成步骤⑥,则沉淀物C必需在_______(填仪器名称)中灼烧。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com