
| A、单位时间内生成nmolA2的同时消耗n molAB |
| B、容器内,3种气体AB、A2、B2共存 |
| C、AB的消耗速率等于A2的消耗速率 |
| D、容器中各组分的体积分数不随时间变化 |


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
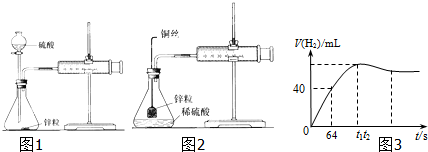
查看答案和解析>>
科目:高中化学 来源: 题型:
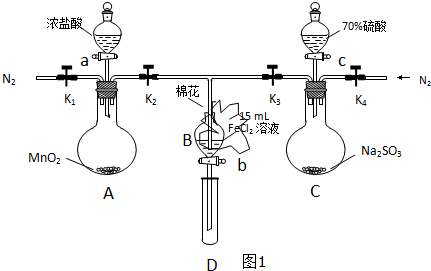
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
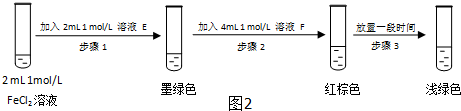
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐溶液都是中性的 |
| B、盐溶液的酸碱性与盐的类型无关 |
| C、NaHCO3溶液显酸性 |
| D、碳酸钠溶液显碱性,溶液中c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| M |
| M |
| 选 项 | X | Y | Z | M |
| A | NH3 | NO | NO2 | O2 |
| B | NaOH | Na2SO3 | NaHSO3 | SO2 |
| C | Al2O3 | NaAlO2 | Al(OH)3 | NaOH |
| D | Mg | C | CO | CO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与盐酸反应 CO32-+2H+═CO2↑+H2O |
| B、硫酸和氯化钡溶液反应 Ba2++SO42-═BaSO4↓ |
| C、氢氧化钠和足量二氧化碳反应 2OH-+CO2═CO32-+H2O |
| D、铁钉放入硫酸铜溶液中 Fe+3Cu2+═2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
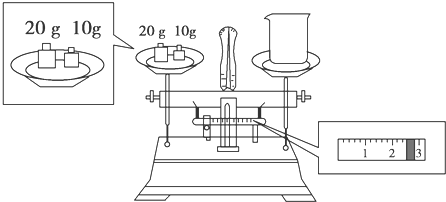
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用盐酸冲洗 |
| C、用点燃的火柴在液化气钢瓶口检验是否漏气 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com