
【题目】下列各项中,属于微量元素的是
A. C、H、N、P、Mn B. Cl、Fe、S、N、Mg
C. B、Cu、Zn、Mn、Mo D. N、P、K、Cu、Fe
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在“绿色化学”工艺中,理想的状态是反应物中的原子全部转化为期望的最终产物,即原子的利用率为100%。下列反应类型中能体现“原子经济性”原则的是( )
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥加聚反应
A.①②⑤ B.②⑤⑥ C.③④ D.只有⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。第三代太阳能电池就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池及薄膜Si系太阳能电池。
(1)现代化学中,常利用 上的特征谱线来鉴定元素
(2)铟是镓的同主族的相邻元素,它位于元素周期表的 区,它的价电子排布式是 。
(3)硒为第4周期氧族元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 。(用元素符号表示)
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有特殊的性质。如BF3与一定量水能形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及 (填序号)
A离子键 B共价键 C配位键 D金属键 e氢键 f范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化

(5)一种铜金合金晶体如图所示(Au原子位于顶点,Cu原子位于面心),则该合金中Au原子与Cu原子个数之比为__________,若该晶胞的边长为a pm,则合金的密度为___________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO2 | H2 | CO | H2O(g) | |
甲 | a mol | a mol | 0 mol | 0 mol |
乙 | 2a mol | a mol | 0 mol | 0 mol |
丙 | 0 mol | 0 mol | a mol | a mol |
丁 | a mol | 0 mol | a mol | a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是 ( )
A.乙>丁>甲>丙 B.乙=丁>丙=甲
C.丁>乙>丙=甲 D.丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
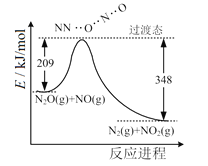
A.反应生成1mol N2时转移4 mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g) = N2(g)+NO2(g) △H=-139kJ/mol
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2恰好使溶液恢复到电解前的浓度和pH,则电解过程中转移电子的物质的量为
A. 0.4mol B. 0.3 mol C. 0.2 mol D. 0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)0.4 mol OH-的质量为 ,其中含有 个电子。
(2)质量比为16:7:6的三种气体SO2、CO、NO氧原子个数之比为 ;同条件下体积比为 。
(3)标准状况下,1体积水能溶解448体积HCI,所得溶液的密度为1.1 g/mL,该溶液的质量分数和物质的量的浓度分别是 、 。(保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分燃烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00ml。已知:
SO2+Fe3++2H2O=SO42-+Fe2++4H+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数 (假设杂质不参加反应)。
(2)若燃烧6gFeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式 。
(3)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸的质量为 t,SO2全部转化为SO3时放出的热量是 kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=aKJ ·mol-1
2Fe(s)+3CO2(g) △H=aKJ ·mol-1
(1)已知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0kJ·mol-1
C(石墨)+CO2(g)=2CO(g) △H2=+172.5kJ·mol-1
则a= kJ·mol-1。
(2)冶炼铁反应的平衡常数表达式K= ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | ||
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 | |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 | |
甲容器中CO的平衡转化率为 。
②下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲、乙容器中,CO的平衡浓度之比为2:3
c.增加Fe2O3可以提高CO2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com