
【题目】黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分燃烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00ml。已知:
SO2+Fe3++2H2O=SO42-+Fe2++4H+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数 (假设杂质不参加反应)。
(2)若燃烧6gFeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式 。
(3)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸的质量为 t,SO2全部转化为SO3时放出的热量是 kJ。
【答案】(1)90%(2)SO3(g)+H2O(l)=H2SO4(l) △H=-130.3kJ/mol
(3)3.36×106 15 3.43×107
【解析】
试题分析:(1)取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL.
依据反应过程得到定量关系为:3FeS2~6SO2~12Fe2+~2Cr2O72-,假设硫化亚铁物质的量为x,则:3FeS2~6SO2~12Fe2+~2Cr2O72-,
3 2
x 0.02000mol/l×0.02500L
x=0.00075mol;
所以样品中FeS2的质量分数=![]() ×100%=90%;
×100%=90%;
(2)灼烧6g FeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,依据硫元素守恒n(S)=2n(FeS2)=6g÷120g/mol×2=0.1mol,产生的0.1molSO3与水全部化合生成H2SO4,放出13.03kJ热量,1molSO3与水全部化合生成H2SO4,放出130.3kJ,SO3气体转化为H2SO4的热化学方程式为:SO3(g)+H2O(l)═H2SO4(l);△H═-130.3 kJ/mol;
(3)煅烧10t上述黄铁矿,含有FeS2的质量=10×106×90%=9×106g,物质的量=9×106g÷120g/mol=7.5×104mol,依据硫元素守恒,理论上产生SO2的体积=7.5×104mol×2×22.4L/mol=3.36×106 L;理论上得到硫酸物质的量为7.5×104mol×2=1.5×105mol,质量=1.5×105mol×98g/mol=1.47×107g;制得98%的硫酸质量=1.47×107g÷98%=1.5×107g=15t;依据(2)可知,0.1mol二氧化硫全部反应生成三氧化硫放热9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,1.5×105molSO2全部转化为H2SO4时放出的热量=1.5×105mol×98.3KJ/mol+1.5×105mol×130.3KJ/mol=3.429×107KJ。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述不正确的是: ( )
A. 铜锌原电池中铜是正极
B. 用电解法精炼铜时粗铜作阳极
C. 在镀件上镀铜时可用铜作阳极
D. 电解稀硫酸溶液制H2、O2时铜做阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中,属于微量元素的是
A. C、H、N、P、Mn B. Cl、Fe、S、N、Mg
C. B、Cu、Zn、Mn、Mo D. N、P、K、Cu、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示①、②两个装置的叙述中,正确的是( )

A.硫酸浓度变化:①增大,②减小
B.装置名称:①是原电池,②是电解池
C.电极反应式:①中阳极:4OH--4e-=2H2O+O2↑;②中正极:Zn-2e-===Zn2+
D.离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①是通过O2与C反应实现的,测知生成14gCO时放出60kJ的热量,则其热化学方程式为 。

(2)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0 ③
2H2(g)+O2(g)=2H2O(g) △H4<0 ④
则途径I放出的热量 (填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是 。
(3)甲醇(CH3OH)是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25℃、101kPa下,1 克液态甲醇完全燃料放热25kJ,写出甲醇燃烧生成1molCO2的热化学方程式 。若将该反应设计成原电池反应,用稀H2SO4 作电解质,则其电极方程式分别为正极: 负极:
(4)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) △H= - 400kJ·mol―1
2CO(g)+O2(g)=2CO2(g) △H= - 560kJ·mol―1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) △H=+140kJ·mol―1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
(5)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) △H=―260kJ·mol―1
已知:2Ag2O(s)=4Ag(s)+O2(g) △H=+70kJ·mol―1
则O3转化为O2的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为原料在不同条件下可以合成多种有机物。
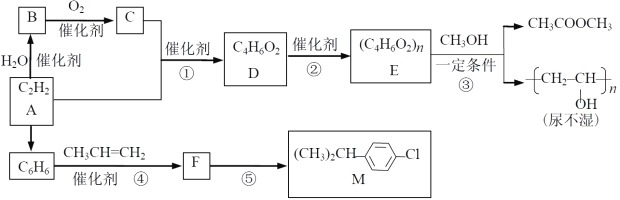
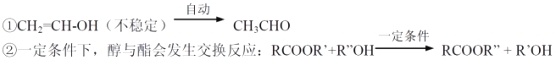
已知:
(1)B 中官能团名称 ;④的反应类型 。
(2)⑤的反应条件 。
(3)③的化学方程式 。
(4)D 的同分异构体中含碳碳双键、能发生银镜反应且属于酯的共有 种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于晶体的下列说法正确的是( )
A. 在晶体中只要有阴离子就一定有阳离子
B. 在晶体中只要有阳离子就一定有阴离子
C. 金属能导电是因为金属晶体中的自由电子在外加电场作用下可发生定向移动
D. 分子晶体的熔点一定比金属晶体的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol/LNaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
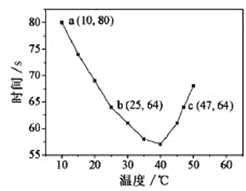
A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3反应速率相等
C. 图中a点对应的NaHSO3反应速率为5.0×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别物质的方法错误的是( )
A. 用酚酞鉴别食盐水和稀醋酸
B. 用水鉴别生石灰和石灰石
C. 用燃着的木条鉴别空气和二氧化碳
D. 用氯化钡溶液鉴别稀盐酸和稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com