
【题目】下列关于铜电极的叙述不正确的是: ( )
A. 铜锌原电池中铜是正极
B. 用电解法精炼铜时粗铜作阳极
C. 在镀件上镀铜时可用铜作阳极
D. 电解稀硫酸溶液制H2、O2时铜做阳极
科目:高中化学 来源: 题型:
【题目】如图所示:

下列说法正确的是
A.甲池通入O2的电极反应为O2 + 4e-+ 4H+=2H2O
B.乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“绿色化学”工艺中,理想的状态是反应物中的原子全部转化为期望的最终产物,即原子的利用率为100%。下列反应类型中能体现“原子经济性”原则的是( )
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥加聚反应
A.①②⑤ B.②⑤⑥ C.③④ D.只有⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1 的平衡常数为K1;
FeO(s)+CO(g) ΔH1 的平衡常数为K1;
反应②Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2 的平衡常数为K2。
FeO(s)+H2(g) ΔH2 的平衡常数为K2。
反应③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3 的平衡常数为K3。
CO(g)+H2O(g) ΔH3 的平衡常数为K3。
不同温度时K1、K2的值如下表,下列说法正确的是 ( )
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
A.K3= K1-K2 B.K3= K1+ K2 C.ΔH3 > 0 D.ΔH3 < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国三峡工程所提供的清洁、廉价、可再生的水电,相当于每年燃烧 3000 万吨原煤的火力发电厂产生的电能,因此三峡工程有助于控制 ①温室效应 ②SO2的排放 ③白色污染 ④臭氧空洞( )
A.①② B.①②③ C.①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
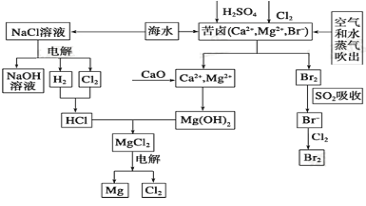
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) _____________________。
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是______________,电解饱和食盐水的化学反应方程式为_____________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,其原因是_____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,其原因是_____________________。
(3)苦卤中先通入Cl2置换出Br2 ,为什么吹出后用SO2吸收转化为Br-再用Cl2置换,其理由是_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为_______________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2 ,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。第三代太阳能电池就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池及薄膜Si系太阳能电池。
(1)现代化学中,常利用 上的特征谱线来鉴定元素
(2)铟是镓的同主族的相邻元素,它位于元素周期表的 区,它的价电子排布式是 。
(3)硒为第4周期氧族元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 。(用元素符号表示)
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有特殊的性质。如BF3与一定量水能形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及 (填序号)
A离子键 B共价键 C配位键 D金属键 e氢键 f范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化

(5)一种铜金合金晶体如图所示(Au原子位于顶点,Cu原子位于面心),则该合金中Au原子与Cu原子个数之比为__________,若该晶胞的边长为a pm,则合金的密度为___________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO2 | H2 | CO | H2O(g) | |
甲 | a mol | a mol | 0 mol | 0 mol |
乙 | 2a mol | a mol | 0 mol | 0 mol |
丙 | 0 mol | 0 mol | a mol | a mol |
丁 | a mol | 0 mol | a mol | a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是 ( )
A.乙>丁>甲>丙 B.乙=丁>丙=甲
C.丁>乙>丙=甲 D.丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分燃烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00ml。已知:
SO2+Fe3++2H2O=SO42-+Fe2++4H+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数 (假设杂质不参加反应)。
(2)若燃烧6gFeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式 。
(3)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸的质量为 t,SO2全部转化为SO3时放出的热量是 kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com