
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
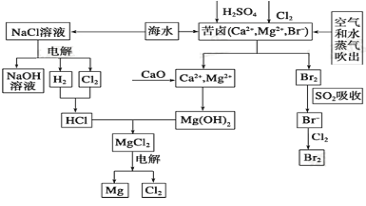
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) _____________________。
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是______________,电解饱和食盐水的化学反应方程式为_____________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,其原因是_____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,其原因是_____________________。
(3)苦卤中先通入Cl2置换出Br2 ,为什么吹出后用SO2吸收转化为Br-再用Cl2置换,其理由是_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为_______________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2 ,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
【答案】
(1)BaCl2、NaOH、Na2CO3、HCl;
(2)①阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯;2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH;②防止MgCl2水解;
Cl2↑+H2↑+2NaOH;②防止MgCl2水解;
(3)第一次吹出的Br2浓度太低,分离浪费原料,SO2吸收主要起到富集作用;Cl2>Br2>SO2
(4)3Br2+3CO32-═5Br-+BrO-3+3CO2↑;蒸馏
【解析】
试题分析:(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为:BaCl2、NaOH、Na2CO3、HCl,故答案为:BaCl2、NaOH、Na2CO3、HCl;
(2)①阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电解电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯,电解饱和食盐水反应的化学方程式为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,故答案为:阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯; 2NaCl+2H2O
Cl2↑+H2↑+2NaOH,故答案为:阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯; 2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH;
②氯化镁在水中乙发生水解,为抑制水解,氯化镁晶体应在氯化氢气流中脱水,故答案为:在HCl气流中加热脱水(防止MgCl2水解);故答案为:防止MgCl2水解;
(3)苦卤中通入Cl2已经置换出Br2,吹出后用SO2吸收转化为Br-再用Cl2置换是为了富集溴元素,第一次吹出的Br2浓度太低,分离浪费原料,SO2吸收主要起到富集作用,在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性,氧化剂氧化性大于氧化产物,Cl2+2Br-=Br2+2Cl-中还原性 Br->Cl-,SO2+2H2O+Br2=H2SO4+2HBr中还原性SO2>Br-,所以还原性强弱顺序是 SO2>Br->Cl-,氧化性强弱顺序为:Cl2>Br2>SO2,故答案为:第一次吹出的Br2浓度太低,分离浪费原料,SO2吸收主要起到富集作用 Cl2>Br2>SO2
(4)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,反应的离子方程式为:3Br2+3CO32-═5Br-+BrO-3+3CO2↑,生成溴化钠和溴酸钠,最后再用H2SO4处理得到Br2,加入CCl4进行Br2的萃取最后通过蒸馏操作分离得到溴单质,故答案为:3Br2+3CO32-═5Br-+BrO-3+3CO2↑;蒸馏。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2 L的密闭容器中充入A气体、B气体,测得其浓度2 mol/L和1 mol/L;且发生如下反应:3A(g)+2B(g)![]() 2C(?)+3D(?)ΔH =+a kJ·mol-1,已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5∶3,则下列说法中正确的是
2C(?)+3D(?)ΔH =+a kJ·mol-1,已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5∶3,则下列说法中正确的是
A.保持体积不变的情况下,向该体系中充入He气,反应速率加快,平衡正动
B.此时B的转化率为20%
C.增大该体系压强,平衡向右移动,但化学平衡常数不变
D.增加C的量,A、B转化率减小,ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+。对于该平衡,下列叙述正确的是 ( )
CH3COO-+H+。对于该平衡,下列叙述正确的是 ( )
A.加入水时,平衡向逆反应方向移动
B.加入少量冰醋酸,平衡向正反应方向移动,电离程度减小
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述不正确的是: ( )
A. 铜锌原电池中铜是正极
B. 用电解法精炼铜时粗铜作阳极
C. 在镀件上镀铜时可用铜作阳极
D. 电解稀硫酸溶液制H2、O2时铜做阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠晶体俗称红矾钠,是重要的化工产品和强氧化剂。工业上用含有Al2O3、Fe2O3等杂质的铬铁矿【主要成份为Fe(CrO2)2】为主要原料生产重铭酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:
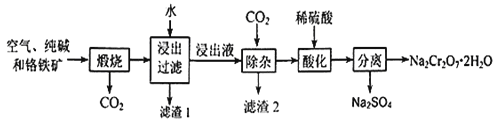
已知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,放出CO2气体,同时发生反应:A12O3+Na2CO3![]() 2NaAlO2+CO2↑。请回答下列问题:
2NaAlO2+CO2↑。请回答下列问题:
(1)煅烧前通常将铬铁矿粉碎,原因是 。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(3)滤渣2的成分为 (填写化学式)
(4)请写出用稀硫酸酸化处理时发生反应的离子方程式 、 。
(5)称取重铬酸钠晶体试样2.500g配成250ml溶液,取出25ml于锥形瓶中,加入10mL 2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断滴定达到终点的现象是 ;
②若实验中共用去Na2S2O3标准溶液40.00ml,则所得产品Na2Cr2O7·2H2O的纯度为 (设整个过程中其它杂质不参加反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生命体中会不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)、实验室用金属铜和稀硝酸制取NO的化学方程式:________________。
最适宜的收集方法是( )


(2)、NO是有毒气体,某学生为防止污染,用分液漏斗和 烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示。实验室用小铜粒做实验,在使用上述装置进行实验时,可用丝状材料包裹铜粒进行,这丝状材料的成分可以是________________(填选项编号)
A.铁 B.铝 C.玻璃
用丝状材料包裹的原因是__________________。
(3)、将(2)题图中分液漏斗的活塞打开,使反应进行,在分液漏斗中看到________色气体。原因是(填化学方程式):__________________。
(4)、为证明铜丝与稀硝酸反应生成的确实是NO,某同学另设计了一套如图所示制取NO的装置。
在带有铜丝的塞子插入硝酸的同时拔去左边的塞子,反应发生,再过一段时间后发现反应会自动停止,其原因是____________________。
(5)、在(4)题反应结束后右管上端可以看到有一段无色气体,为了验证该气体为NO,能否将带铜丝的塞子拔去?__________(能、不能),理由是_________________。
(6)、若带铜丝的塞子不拔去,将左管的塞子塞上后,只需一个简单的操作即可验证无色气体为NO,该操作是_________________;过一段时间后,气体颜色慢慢变浅,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为原料在不同条件下可以合成多种有机物。
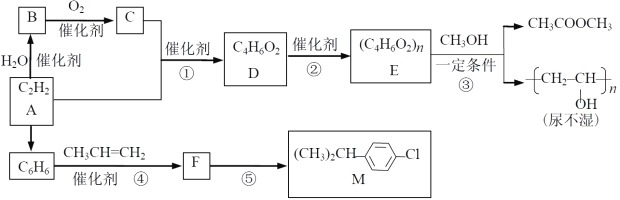
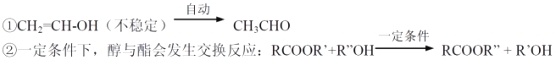
已知:
(1)B 中官能团名称 ;④的反应类型 。
(2)⑤的反应条件 。
(3)③的化学方程式 。
(4)D 的同分异构体中含碳碳双键、能发生银镜反应且属于酯的共有 种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com