
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生命体中会不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)、实验室用金属铜和稀硝酸制取NO的化学方程式:________________。
最适宜的收集方法是( )


(2)、NO是有毒气体,某学生为防止污染,用分液漏斗和 烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示。实验室用小铜粒做实验,在使用上述装置进行实验时,可用丝状材料包裹铜粒进行,这丝状材料的成分可以是________________(填选项编号)
A.铁 B.铝 C.玻璃
用丝状材料包裹的原因是__________________。
(3)、将(2)题图中分液漏斗的活塞打开,使反应进行,在分液漏斗中看到________色气体。原因是(填化学方程式):__________________。
(4)、为证明铜丝与稀硝酸反应生成的确实是NO,某同学另设计了一套如图所示制取NO的装置。
在带有铜丝的塞子插入硝酸的同时拔去左边的塞子,反应发生,再过一段时间后发现反应会自动停止,其原因是____________________。
(5)、在(4)题反应结束后右管上端可以看到有一段无色气体,为了验证该气体为NO,能否将带铜丝的塞子拔去?__________(能、不能),理由是_________________。
(6)、若带铜丝的塞子不拔去,将左管的塞子塞上后,只需一个简单的操作即可验证无色气体为NO,该操作是_________________;过一段时间后,气体颜色慢慢变浅,其原因是_____________。
【答案】(1)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O D
(2)C 防止铜粒掉入硝酸无法使反应随关随停
(3)红棕色 2NO+O2=2NO2
(4)Cu与硝酸产生难溶于水的NO气体,将硝酸排向左边,从而Cu与硝酸脱离(2分)
(5)不能 NOx会产生污染(6)U型管的管口向下倒转过来
NO2溶于水产生NO(或3NO2+H2O=2HNO3 +NO)
【解析】
试题分析:(1)实验室用金属铜和稀硝酸制取NO的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;NO易被氧气氧化为NO2,所以不能排空气法收集;NO不溶于水,所以利用排水法收集,答案选D。
(2)铁和铝均能与稀硝酸反应,所以选择玻璃,答案选C;为了防止铜粒掉入硝酸无法使反应随关随停,因此需要用丝状材料包裹;
(3)铜与稀硝酸反应生成的NO易被氧化为NO2,所以实验现象是产生红棕色气体,反应的化学方程式为2NO+O2=2NO2;
(4)Cu与硝酸产生难溶于水的NO气体,将硝酸排向左边,从而Cu与硝酸脱离,因此再过一段时间后发现反应会自动停止。
(5)由于NOx会产生污染,所以不能将带铜丝的塞子拔去;
(6)由于NO2能溶于水生成硝酸和NO,所以验证无色气体为NO的操作是U型管的管口向下倒转过来,反应的方程式为3NO2+H2O=2HNO3 +NO。


科目:高中化学 来源: 题型:
【题目】可逆反应A(?)+a B(g)![]() C(g)+2 D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C(g)+2 D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
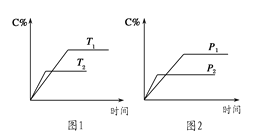
A.当压强由p1变为 p2时,逆反应速率将变大
B.该反应的正反应为放热反应
C.若a=2,则A为液态或固体
D.恒温恒容条件下,增加B的物质的量,B的转化率和该反应的化学平衡常数都将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
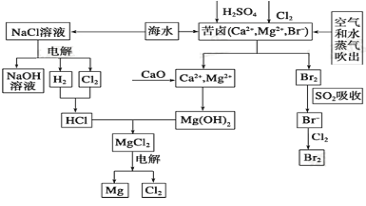
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) _____________________。
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是______________,电解饱和食盐水的化学反应方程式为_____________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,其原因是_____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,其原因是_____________________。
(3)苦卤中先通入Cl2置换出Br2 ,为什么吹出后用SO2吸收转化为Br-再用Cl2置换,其理由是_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为_______________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2 ,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应mA(g)+nB(g) ![]() pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是( )
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是( )
A.化学计量数:m+n<p B.平衡向正反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO2 | H2 | CO | H2O(g) | |
甲 | a mol | a mol | 0 mol | 0 mol |
乙 | 2a mol | a mol | 0 mol | 0 mol |
丙 | 0 mol | 0 mol | a mol | a mol |
丁 | a mol | 0 mol | a mol | a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是 ( )
A.乙>丁>甲>丙 B.乙=丁>丙=甲
C.丁>乙>丙=甲 D.丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知:铝热反应放热,①4Al(s)+3O2(g)=2Al2O3(s) H1②4Fe(s)+3O2(g)===2Fe2O3(s) H2 下面关于 H1、H2 的比较正确的是( )
A. H1<H2 B. H1=H2 C. H1>H2 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2恰好使溶液恢复到电解前的浓度和pH,则电解过程中转移电子的物质的量为
A. 0.4mol B. 0.3 mol C. 0.2 mol D. 0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于溶液的酸碱性说法正确的是
A.c(H+)很小的溶液一定呈碱性 B.pH=7的溶液一定呈中性
C.c(OH-)=c(H+)的溶液一定呈中性 D.能使酚酞试液变红的溶液一定呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.0mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
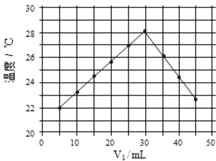
A. 做该实验时环境温度为22℃ B. 该实验表明热能可转化为化学能
C. NaOH溶液的浓度约为1.5mol·L-1 D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com