
【题目】重铬酸钠晶体俗称红矾钠,是重要的化工产品和强氧化剂。工业上用含有Al2O3、Fe2O3等杂质的铬铁矿【主要成份为Fe(CrO2)2】为主要原料生产重铭酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:
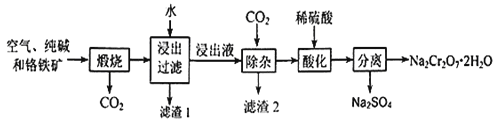
已知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,放出CO2气体,同时发生反应:A12O3+Na2CO3![]() 2NaAlO2+CO2↑。请回答下列问题:
2NaAlO2+CO2↑。请回答下列问题:
(1)煅烧前通常将铬铁矿粉碎,原因是 。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(3)滤渣2的成分为 (填写化学式)
(4)请写出用稀硫酸酸化处理时发生反应的离子方程式 、 。
(5)称取重铬酸钠晶体试样2.500g配成250ml溶液,取出25ml于锥形瓶中,加入10mL 2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断滴定达到终点的现象是 ;
②若实验中共用去Na2S2O3标准溶液40.00ml,则所得产品Na2Cr2O7·2H2O的纯度为 (设整个过程中其它杂质不参加反应)
【答案】
(1)增大接触面积,加快反应速率
(2)FeOCr2O3 ;
(3) Al(OH)3
(4)2CrO42-+2H+![]() Cr2O72-+H2O;CO32-+2H+==H2O+CO2↑(HCO3-与H+反应同样得分)
Cr2O72-+H2O;CO32-+2H+==H2O+CO2↑(HCO3-与H+反应同样得分)
(5)①当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去,且半分钟内不复原;②95.36 %
【解析】
试题分析:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,同时A12O3+Na2CO3 ![]() 2NaAlO2+CO2↑,可知主反应为4Fe(CrO2)2+7O2+8Na2CO3
2NaAlO2+CO2↑,可知主反应为4Fe(CrO2)2+7O2+8Na2CO3![]() 8Na2CrO4+2Fe2O3+8CO2,铬铁矿在空气中与纯碱煅烧生成物通过水浸NaAlO2进入浸出液中,而不溶的Fe2O3形成滤渣1,浸出液通过除杂,通入CO2气体,形成滤渣2Al(OH)3沉淀,最后分离出Na2CrO4溶液,经过酸化、过滤、结晶得到最终产品重铬酸钠晶体( Na2Cr2O72H2O)。
8Na2CrO4+2Fe2O3+8CO2,铬铁矿在空气中与纯碱煅烧生成物通过水浸NaAlO2进入浸出液中,而不溶的Fe2O3形成滤渣1,浸出液通过除杂,通入CO2气体,形成滤渣2Al(OH)3沉淀,最后分离出Na2CrO4溶液,经过酸化、过滤、结晶得到最终产品重铬酸钠晶体( Na2Cr2O72H2O)。
(1)煅烧前通常将铬铁矿粉碎,增大了矿石与空气的接触面积,加快了反应速率,故答案为:增大接触面积,加快反应速率;
(2)根据Na2SiO3可写成Na2O·SiO2, Fe(CrO2)2可写成FeOCr2O3,故答案为:FeOCr2O3;
(3)煅烧时铬铁矿的成分之一Fe2O3没有参与反应,也不溶解与水中,所以滤渣1的成分为Fe2O3,铬铁矿煅烧时生成的NaAlO2在水溶液中与CO2生成Al(OH)3沉淀,故滤渣2的成分为Al(OH)3,故答案为:Al(OH)3;
(4)分离出Na2CrO4溶液,经过酸化、过滤、结晶得到最终产品重铬酸钠晶体( Na2Cr2O72H2O)用稀硫酸酸化处理时发生反应的离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O;CO32-+2H+==H2O+CO2↑,故答案为:2CrO42-+2H+
Cr2O72-+H2O;CO32-+2H+==H2O+CO2↑,故答案为:2CrO42-+2H+![]() Cr2O72-+H2O;CO32-+2H+==H2O+CO2↑;
Cr2O72-+H2O;CO32-+2H+==H2O+CO2↑;
(5)①溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,故答案为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②根据反应的关系式计算:
Cr2O72-~3I2~6S2O32-
1mol 6mol
n 0.1200molL-1×0.04L
n=0.0008mol,则2.5000g重铬酸钠试样中含有的重铬酸钠的质量为10×0.0008mol×298g/moL=2.384g,所得产品的中重铬酸钠的纯度=![]() ×100%=95.36%,故答案为:95.36%。
×100%=95.36%,故答案为:95.36%。


科目:高中化学 来源: 题型:
【题目】下列溶液一定呈酸性的是 ( )
①pH<7 ②c(H+)>c(OH﹣)的溶液 ③c(H+)=10﹣6 molL﹣1的溶液④使甲基橙显红色的溶液。
A. ②④ B. ①②③④ C. ②③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
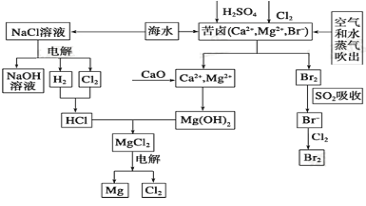
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) _____________________。
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是______________,电解饱和食盐水的化学反应方程式为_____________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,其原因是_____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,其原因是_____________________。
(3)苦卤中先通入Cl2置换出Br2 ,为什么吹出后用SO2吸收转化为Br-再用Cl2置换,其理由是_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为_______________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2 ,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,由水电离的c(H+)=1×10-13mol/L的溶液中一定不可能大量存在的离子是
A. NH4+ B. HSO3- C. AlO2- D. Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应mA(g)+nB(g) ![]() pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是( )
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是( )
A.化学计量数:m+n<p B.平衡向正反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知:铝热反应放热,①4Al(s)+3O2(g)=2Al2O3(s) H1②4Fe(s)+3O2(g)===2Fe2O3(s) H2 下面关于 H1、H2 的比较正确的是( )
A. H1<H2 B. H1=H2 C. H1>H2 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示:下列说法中正确的是
2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示:下列说法中正确的是
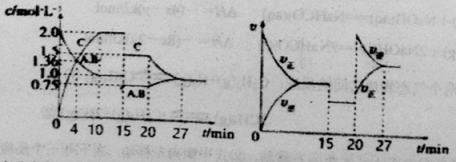
A.4min时反应第一次达到平衡
B.15min时降低压强,20min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.15~20min该反应使用了催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com