
【题目】下列溶液一定呈酸性的是 ( )
①pH<7 ②c(H+)>c(OH﹣)的溶液 ③c(H+)=10﹣6 molL﹣1的溶液④使甲基橙显红色的溶液。
A. ②④ B. ①②③④ C. ②③ D. ①②③
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组对手性分子提出了以下四个观点:
①互为手性异构体的分子互为镜像 ②利用手性催化剂合成可得到一种或主要得到一种手性分子 ③手性异构体分子组成相同 ④手性异构体性质相同 你认为正确的是( )
A. ①②③ B. ①②④ C. ②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学反应能量变化相关的叙述正确的是( )
A.反应物总能量低于生成物总能量时,该反应一定不能发生
B.化学键的键能越大,物质的能量越高
C.一个反应的焓变因反应物的用量和反应条件的改变而发生改变
D.应用盖斯定律,可计算某些难以直接测量的反应焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g) ![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是 ( )
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是 ( )
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() x mol
x mol
A.① B.①② C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠晶体俗称红矾钠,是重要的化工产品和强氧化剂。工业上用含有Al2O3、Fe2O3等杂质的铬铁矿【主要成份为Fe(CrO2)2】为主要原料生产重铭酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:
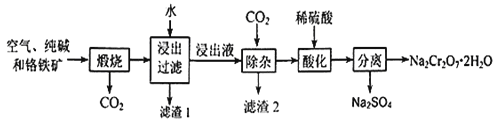
已知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,放出CO2气体,同时发生反应:A12O3+Na2CO3![]() 2NaAlO2+CO2↑。请回答下列问题:
2NaAlO2+CO2↑。请回答下列问题:
(1)煅烧前通常将铬铁矿粉碎,原因是 。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(3)滤渣2的成分为 (填写化学式)
(4)请写出用稀硫酸酸化处理时发生反应的离子方程式 、 。
(5)称取重铬酸钠晶体试样2.500g配成250ml溶液,取出25ml于锥形瓶中,加入10mL 2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断滴定达到终点的现象是 ;
②若实验中共用去Na2S2O3标准溶液40.00ml,则所得产品Na2Cr2O7·2H2O的纯度为 (设整个过程中其它杂质不参加反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用浓盐酸配制l∶l(体积比)的稀盐酸(约6mol/L)100mL,应选用的定量仪器
A. 量筒 B. 滴定管 C. 50mL容量瓶 D. 100mL容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO![]() )=6 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体22.4 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
)=6 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体22.4 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(Na+)=6 mol
B.电解后得到的Cu的物质的量为2 mol
C.上述电解过程中共转移8 mol电子
D.电解后溶液中c(H+)=4 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com