
【题目】化学式能表示物质分子组成的是
A. C6H6 B. SiO2 C. NaOH D. NH4Cl
科目:高中化学 来源: 题型:
【题目】配平下列化学方程式或离子方程式。
(1)![]() KI+
KI+![]() KIO3+
KIO3+![]() H2SO4=
H2SO4=![]() I2+
I2+![]() K2SO4+
K2SO4+![]() H2O
H2O
(2)![]() MnO+
MnO+![]() H++
H++![]() Cl-=
Cl-=![]() Mn2++
Mn2++![]() Cl2↑+
Cl2↑+![]() H2O
H2O
(3)![]() P4+
P4+![]() KOH+
KOH+![]() H2O=
H2O=![]() K3PO4+
K3PO4+![]() PH3
PH3
(4)![]() ClO-+
ClO-+![]() Fe(OH)3+
Fe(OH)3+![]() ________=
________=![]() Cl-+
Cl-+![]() FeO+
FeO+![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(?)+a B(g)![]() C(g)+2 D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C(g)+2 D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
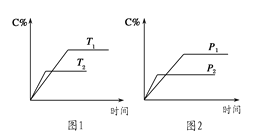
A.当压强由p1变为 p2时,逆反应速率将变大
B.该反应的正反应为放热反应
C.若a=2,则A为液态或固体
D.恒温恒容条件下,增加B的物质的量,B的转化率和该反应的化学平衡常数都将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1 的平衡常数为K1;
FeO(s)+CO(g) ΔH1 的平衡常数为K1;
反应②Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2 的平衡常数为K2。
FeO(s)+H2(g) ΔH2 的平衡常数为K2。
反应③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3 的平衡常数为K3。
CO(g)+H2O(g) ΔH3 的平衡常数为K3。
不同温度时K1、K2的值如下表,下列说法正确的是 ( )
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
A.K3= K1-K2 B.K3= K1+ K2 C.ΔH3 > 0 D.ΔH3 < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈酸性的是 ( )
①pH<7 ②c(H+)>c(OH﹣)的溶液 ③c(H+)=10﹣6 molL﹣1的溶液④使甲基橙显红色的溶液。
A. ②④ B. ①②③④ C. ②③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
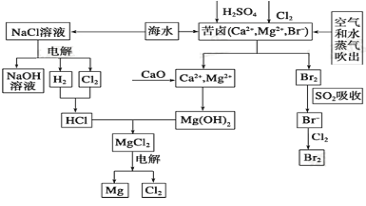
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) _____________________。
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是______________,电解饱和食盐水的化学反应方程式为_____________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,其原因是_____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,其原因是_____________________。
(3)苦卤中先通入Cl2置换出Br2 ,为什么吹出后用SO2吸收转化为Br-再用Cl2置换,其理由是_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为_______________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2 ,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应mA(g)+nB(g) ![]() pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是( )
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是( )
A.化学计量数:m+n<p B.平衡向正反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于溶液的酸碱性说法正确的是
A.c(H+)很小的溶液一定呈碱性 B.pH=7的溶液一定呈中性
C.c(OH-)=c(H+)的溶液一定呈中性 D.能使酚酞试液变红的溶液一定呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com