
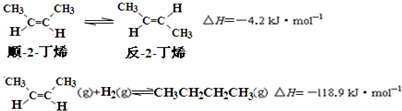
| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: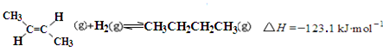 |
分析 A.能量越低越稳定;
B.若生成物相同,反应物的能量高,则放出的热量多;
C.生成正丁烷的反应为气体体积减小的放热反应;
D.盖斯定律指若一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同.
解答 解:A.顺-2-丁烯转化为反-2-丁烯放热,说明反-2-丁烯能量低,更稳定,故A正确;
B.等量的顺-2-丁烯具有更高的能量.所以顺-2-丁烯燃烧热更大,故B错误;
C.生成正丁烷的反应为气体体积减小的放热反应,所以减压向逆向移动,升温也向逆向移动,所以减压和升温不利于平衡向生成正丁烷反应方向移动,故C错误;
D.将下式-上式相加得到反-2-丁烯氢化的热化学方程式,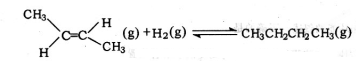 △H=-118.9kJ•mol-1-(-4.2kJ•mol-1)=-114.7kJ•mol-1,故D错误.
△H=-118.9kJ•mol-1-(-4.2kJ•mol-1)=-114.7kJ•mol-1,故D错误.
故选A.
点评 本题考查能量越低越稳定和盖斯定律、影响平衡的因素等,难度适中,注意掌握运用盖斯定律解题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量NH4Cl固体,抑制水的电离 | |
| C. | 向水中加入少量NaOH固体,促进水的电离 | |
| D. | 向水中加入少量NaHSO4固体,抑制水的电离,c(H+)增大,Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol/L | B. | 0.04mol/L | C. | 0.05mol/L | D. | 0.06mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列关于其结构的叙述中,正确的是( )
,下列关于其结构的叙述中,正确的是( )| A. | 甲烷分子是正方形结构 | B. | 甲烷分子是正四面体结构 | ||
| C. | 甲烷分子是极性分子 | D. | 甲烷分子的四个键不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国有较长的海岸线,浩渺的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.
我国有较长的海岸线,浩渺的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
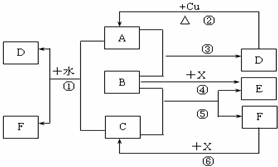
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若NaHA溶液呈酸性,则H2A一定是强酸 | |
| B. | 若NaHA溶液呈碱性,则H2A一定是弱酸 | |
| C. | NaHA溶液中Na+和HA-的个数之比一定大于1:1 | |
| D. | NaHA晶体中的阴阳离子个数比一定是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径比较:X<Y<Z<W | |
| B. | X2H4与H2W都能使溴水褪色 | |
| C. | X的氢化物的沸点一定低于Y的氢化物的沸点 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com