
����Ŀ��̼�����㷺�ķֲ�����Ȼ���У�̼�����Ļ����������������ڹ�ҵ�����ͿƼ���������Ҫ��;��
��1����������Si3N4����һ�������մɲ��ϣ�������SiO2�������̿��1300��1700oC�ĵ������з�Ӧ�Ƶã�3SiO2��s��+6C��s��+2N2��g�� ![]() Si3N4��s��+6CO��g�����SH ��-1591��2 kJ/mol����÷�Ӧÿת��1mole�����ɷų�������Ϊ ��
Si3N4��s��+6CO��g�����SH ��-1591��2 kJ/mol����÷�Ӧÿת��1mole�����ɷų�������Ϊ ��
��2��ij�о�С���ֽ�����CO��g����H2O��g���Ļ������ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У�һ�������·�����Ӧ��CO��g��+H2O��g��![]() CO2��g��+H2��g�����õ��������ݣ�
CO2��g��+H2��g�����õ��������ݣ�
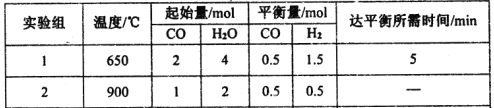
�� ʵ����У�ǰ5min�ķ�Ӧ����v��CO2���� ��
��900��ʱ�÷�Ӧ��ƽ�ⳣ��K =
���������ж�ʵ����Ѿ��ﵽƽ��״̬���� ��
a��������CO��H2O��CO2��H2��Ũ�Ȳ��ٱ仯
b��������ѹǿ���ٱ仯
c�����������ܶȱ��ֲ���
d��v����CO�� ��v����CO2��
e�������������ƽ����Է�����������ʱ����仯
����ʵ���������Ǿ��ȵ��ܱ�������ʵ����H2O��g����ת����H2O%��ʱ��仯��ʾ��ͼ����ͼ��ʾ����b��v�� v���������������������������t3��t4ʱ�̣�H2O��g����ת����H2O%���͵�ԭ���� ��
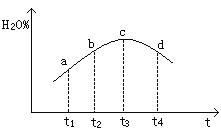
��3������CO��H2��ֱ�Ӻϳɼ״�����ͼ���ɡ��״�-�������γɵ���ɫȼ�ϵ�ص�����ԭ��ʾ��ͼ��д����ʯīΪ�缫�ĵ�ع���ʱ�����ĵ缫��Ӧʽ �����øõ�ص��1L 0��5mol/L��CuSO4��Һ��������560mLO2����״������ʱ��������Һ��pH�� ����Һ���ǰ������ı仯���Բ�������
���𰸡���1��132.6kJ����2���� 0.15mol��L-1��min-1 ����K= 1/ 3����ad���������÷�Ӧ�ﵽƽ�����ӦΪ���ȷ�Ӧ�ҷ�Ӧ����Ϊ�������������������¶����ߣ���Ӧ������У���3��O2+4e-+4H+��2H2O��1��
��������
�����������1�����ݷ�Ӧ����ʽ��ת��12mole���ų�1591.2kJ����������ת��1mole���ų�������Ϊ132.6kJ����2����v��CO��=��2��0.5��/��2��5��mol/��L��min��=0.15 mol/��L��min�������ݻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ�v��CO2��=c��CO��=0.15mol/��L��min�������ﵽƽ��ʱ��n��CO2��=��1��0.5��mol=0.5mol��n��H2O��=��2��0.5��mol=1.5mol�����ݻ�ѧƽ�ⳣ������ѧ����ʽ��K=1/3����a�����ݻ�ѧƽ��״̬�Ķ��壬����ֵ�Ũ�Ȳ��ٸı䣬˵����Ӧ�ﵽƽ�⣬����ȷ��b����Ӧǰ������ϵ��ϵ��֮����ȣ�ѹǿ���ٸı䣬������Ϊ�ﵽ��ѧƽ��ı�־���ʴ���c�������ܶȵĶ��壬��ֶ������壬�������������䣬�Ǻ���״̬�£�������䣬����ܶȲ��䣬����˵���ﵽƽ�⣬�ʴ���d���ò�ͬ���ʵķ�Ӧ�����жϴﵽƽ�⣬Ҫ��Ӧ������һ��һ�棬������֮�ȵ���ϵ��֮�ȣ�����ȷ��e��M=m/n����ֶ������壬�������������䣬��Ӧǰ������ϵ��֮����ȣ������������ʵ����IJ��䣬Ħ���������䣬����˵����Ӧ�ﵽƽ�⣬�ʴ�����b��û�дﵽƽ�⣬��Ӧ������Ӧ������У���v����v�棻���Ǿ����������˷�Ӧ�Ƿ��ȷ�Ӧ���¶����ߣ�ƽ�������ƶ�����3�����ݵ�ع���ԭ�������������Ի��������������ӦʽΪO2��4H����4e��=2H2O��560mL�����õ��������ʵ���Ϊ560��10��3��4/22.4mol=0.1mol�������ϵķ�Ӧ2H2O��4e��=O2����4H��������n��H����=0.1mol��c��H����=0.1/1mol��L��1=0.1mol��L��1����pH=1.


 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϻ�������ij�Ͻ����(��Ҫ��Fe��Cu��Co��Li�ȣ���֪Co��Fe�����еȻ��ý���)�Ĺ����������£�

��1������MΪ ��
��2������H2O2��������(�����ӷ���ʽ��ʾ) �����백ˮ�������� ��
��3��CoC2O4�q2H2O���±��յĻ�ѧ����ʽΪ ��
��4����֪Li2CO3����ˮ���䱥����Һ��Ũ�����¶ȹ�ϵ���±�������2�У�����Ũ���������ȹ��ˣ���Ŀ���� ��90��ʱKsp(Li2CO3)��ֵΪ ��
�¶�/�� | 10 | 30 | 60 | 90 |
Ũ��/molL��1 | 0.21 | 0.17 | 0.14 | 0.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ������ͼ�Ԫ�صĻ����ﲻһ�����к�ǿ�Ļ�ԭ��
B. Ԫ�صĵ���һ������������ԭ��Ԫ�صĻ������Ƶ�
C. ������ֻ�ܵõ��ӱ���ԭ��������ֻ��ʧ���ӱ�����
D. �ڻ�ѧ��Ӧ�У��õ���Խ������������������Ծ�Խǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
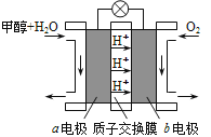
����Ŀ��ͭ�������ڿ����л�Ϳ����е�ˮ������CO2��O2���ò��������⡱���á����⡱�׳ơ�ͭ�̡����ֳơ���ȸʯ��[��ѧʽΪCu2(OH��2CO3]����ͭ�̡��ܸ��ᷴӦ����ͭ�κ�CO2��H2O��ijͬѧ��������ϵ�з�Ӧʵ���ˡ�ͭ��ͭ�̡�������ͭ����ת����
![]()
��1�������ֲ�ͬ������ش�����ͭ�̡������������ʣ� _��
��2����д��ͭ�������ᷴӦ�Ļ�ѧ����ʽ�� ��
��3��д��B�Ļ�ѧʽ ��
��4������ת�����������ڻ��Ϸ�Ӧ���� �����ڸ��ֽⷴӦ���� (���������
��5��д���ٷ�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣 ��֪��
2SO2(g)+O2(g) 2SO3(g) ��H= -196.6kJ��mol��1
2NO(g)+O2(g)![]() 2NO2(g) ��H= -113.0kJ��mol-1
2NO2(g) ��H= -113.0kJ��mol-1
��ӦNO2(g)+SO2(g)![]() SO3(g)+NO(g)����H= kJ��mol-1
SO3(g)+NO(g)����H= kJ��mol-1
��2�����Ƕ�ֲ����������ȱ�ٵ�Ԫ�أ��ϳɰ��ķ�Ӧ����������ʳ�����Ӧ���£�
N2(g)��3H2(g)![]() 2NH3(g)��
2NH3(g)��
��һ�������£���һ������N2��H2�Ļ���������ij�����ܱ������У�һ��ʱ�������������˵���÷�Ӧ�ﵽƽ��״̬���� ������ţ���
A�������л��������ܶȲ���ʱ��仯 |
B������3 mol H-H����ͬʱ�γ�6 mol N-H�� |
C��N2��H2��NH3�����ʵ���֮��Ϊ1:3:2 |
D�������е�ѹǿ����ʱ��仯 |
��3����25 ����101 kPa�£�1 g�״�ȼ������CO2��Һ̬ˮʱ����22.68 kJ����÷�Ӧ���Ȼ�ѧ����ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������̵���Ҫ������ͳ��õ��������������ǹ�ҵ�������̿��Ʊ�������ص�һ�ֹ���������

�� KMnO4ϡ��Һ��һ�ֳ��õ���������������ԭ�������� �������ơ�
A��75%�ƾ� B��˫��ˮ C������ D����84������Һ��NaClO��Һ��
�� ��������NaBiO3��������ˮ�����ڶ��Լ���������Һ��Mn2+�Ĵ�������Ԫ�صĻ�ԭ����ΪBi3+��Mn����������Ϊ+7������д����Ӧ�����ӷ���ʽ�� ��
�� д��MnO2��KOH�����ڻ������ͨ�����ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽ�� ��
�� ��K2MnO4��Һ��ͨ��CO2���Ʊ�KMnO4���÷�Ӧ�еĻ�ԭ���� ��
�� ���������п���ѭ��ʹ�õ�������ʯ�ҡ�CO2�� �� ��д��ѧʽ����
�� ������������ѭ�����Ʊ������е���ʧ����1mol MnO2���Ƶ� mol KMnO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д�����и��л���Ľṹ��ʽ��
��1����Է�������Ϊ114�������ף��������κ���̼ͬԭ������ϩ����H2�õ�����Ľṹ��ʽΪ____________��
��2����֪������A�뻯����B ��ת����ϵΪ��A![]() B���һ�����B�н���4��̼ԭ�ӡ�1����ԭ�ӡ�1����ԭ�ӣ���B�Ľṹ��ʽΪ____________��
B���һ�����B�н���4��̼ԭ�ӡ�1����ԭ�ӡ�1����ԭ�ӣ���B�Ľṹ��ʽΪ____________��
��3��ij��B����ʽΪCnH2n��2��������KMnO4��Һ������õ���
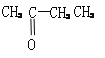 ��
��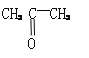 ��
��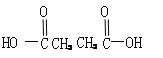
������Ľṹ��ʽΪ____________��
��4��ij��A����Է�������Ϊ84���ú�����ײ�֪�����к���̼̼˫�����ú˴Ź������������ʾֻ��һ�����͵���ԭ�ӡ���A�Ľṹ��ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ����о��õ���Ƭ5.0gͶ��ʢ��50mL0.1molL-1������Һ���ձ���,����Ƭ�����ᷴӦ����������������v(H2)�뷴Ӧʱ��t�Ĺ�ϵ��������ͼ��ʾ��������������ʾ���������۴������
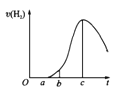
A��O��a�β�������������Ϊ��������������������ϡ����
B��b��c�β����������������ӽϿ����Ҫԭ��֮һ���¶�����
C��t=cʱ�̣���Ӧ����ƽ��
D��t��cʱ���������������ʽ��͵���Ҫԭ������Һ��H��Ũ���½�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ý������ԵIJ�ͬ�����Բ�ȡ��ͬ��ұ������ұ�����������з�Ӧ��������ұ������������ʵ�ֵ����� ��
A��2Al2O3�������� ![]() 4Al��3O2��
4Al��3O2��
B��Fe2O3��3CO ![]() 2Fe��3CO2
2Fe��3CO2
C��Fe��CuSO4 ===FeSO4��Cu
D��2NaCl��ˮ��Һ��![]() 2Na��Cl2��
2Na��Cl2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com