
【题目】(1)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。 已知:
2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH= kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:
N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是 (填序号)。
A.容器中混合气体的密度不随时间变化 |
B.断裂3 mol H-H键的同时形成6 mol N-H键 |
C.N2、H2、NH3的物质的量之比为1:3:2 |
D.容器中的压强不随时间变化 |
(3)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的热化学方程式是____________。
【答案】(1)-41.8 ;(2 ) D;(3 )CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-725.76kJ·mol-1。
【解析】试题分析:(1)已知:①2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6kJ·mol-1;
2SO3(g)ΔH=-196.6kJ·mol-1;
②2NO(g)+O2(g)![]() 2NO2(g)ΔH=-113.0kJ·mol-1。
2NO2(g)ΔH=-113.0kJ·mol-1。
根据盖斯定律:(①-②)÷2得反应
NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=-41.8kJ·mol-1。
SO3(g)+NO(g)的ΔH=-41.8kJ·mol-1。
(2)A.根据质量守恒定律判断容器内气体的质量保持不变,容器的容积恒定,容器内混合气体的密度为恒量,容器中混合气体的密度不随时间变化不能说明反应达到平衡状态,错误;B.断裂3 mol H-H键的同时形成6 mol N-H键,二者均为正反应速率,不能说明反应达到平衡状态,错误;C.N2、H2、NH3的物质的量之比为1:3:2,反应不一定达到平衡状态,错误;D.该反应正向为气体物质的量减小的反应,等温等容的条件下,随着反应的进行,容器内压强逐渐减小,当容器中的压强不随时间变化说明反应达到平衡状态,正确;选D。
(3)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,1mol甲醇燃烧放热32×22.68kJ=725.76kJ,则该反应的热化学方程式是CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-725.76kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是
A.反应A的△H>-115.6kJ·mol-1
B.H2O中H—O键比HCl中H—Cl键弱
C.由II中的数据判断氯元素的非金属性比氧元素强
D.断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)由这五种元素组成的一种化合物是(写化学式)________________________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)用轨道表示式表示D元素原子的价电子构型____________________。
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填﹥、﹤、﹦,并且用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)在①组实验中0.1 mol·L-1HA溶液中水的电离程度为a,0.1 mol·L-1NaOH溶液中水的电离程度为b,所得混合溶液中水的电离程度为c.则a、b、c由大到小的顺序是_________.
(2)在②组实验中c_____0.2(填“<”、“>”或“=”)
(3)根据③组实验所得的混合溶液,其溶液中离子浓度大小排列顺序是____________.
(4)常温下,已知KSP[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeCl3 具有净水作用,但会腐蚀设备,请回答下列问题:
①FeCl3净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
②完成NaClO3 在酸性溶液中氧化FeCl2的离子方程式:
![]() ClO3—+
ClO3—+ ![]() Fe2++
Fe2++ ![]() ==
== ![]() Cl-+
Cl-+ ![]() Fe3++
Fe3++![]()
(2)工业上从海带中提碘,常用硫酸酸化的MnO2氧化I—,写出相关的离子方程式 。
(3)下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是强酸。当X无论是强酸还是强碱时,都有如下转化关系:当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。回答下列问题:
![]()
①当X是强酸时,写出B生成C的化学方程式 。
②当X是强酸时,写出浓的E溶液与过量的B反应的化学方程式 。
③当X是强碱时,简述检验B气体的操作方法和现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮广泛的分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700oC的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g)。⊿H =-1591.2 kJ/mol,则该反应每转移1mole—,可放出的热量为 。
Si3N4(s)+6CO(g)。⊿H =-1591.2 kJ/mol,则该反应每转移1mole—,可放出的热量为 。
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
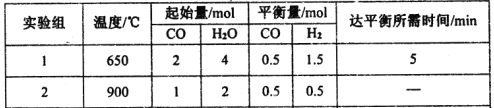
① 实验Ⅰ中,前5min的反应速率v(CO2)= 。
②900℃时该反应的平衡常数K =
③下列能判断实验Ⅱ已经达到平衡状态的是 。
a.容器内CO、H2O、CO2、H2的浓度不再变化
b.容器内压强不再变化
c.混合气体的密度保持不变
d.v正(CO) =v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
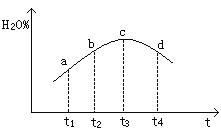
④若实验Ⅲ的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如下图所示,则b点v正 v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是 。
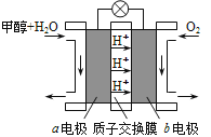
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时正极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素中,每一种都能与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)A、C两元素形成的原子个数比为1:1的化合物,该化合物电子式为 。
(2)B元素的氢化物在催化剂存在的情况下与C元素单质反应的化学方程式为 。
(3)X的水溶液显 (填酸性、碱性或中性),原因是 (用离子方程式表示)。
(4)C和E两元素相比较,非金属性较强的是 (填“元素名称”),可以验证该结论的是 (填“序号”)。
A.比较这两种元索的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(5)C、D两元素形成的原子个数比为1:1的化合物,E、C两元素形成的原子个数比为1:2的化合物,这两种化合物反应的化学方程式为 。
(6)A与C、A与E可分别形成甲、乙两种负一价双原子离子,且甲有10个电子,乙有18个电子,则甲与乙反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA
B.50mL18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA
C.1 molFe溶于过量硝酸,电子转移数为2NA
D.78g Na2O2晶体中含有的离子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应一定属于吸热反应的是
A.破坏生成物全部化学键所需能量小于破坏反应物全部化学键的能量
B.CH3COOH + KOH === CH3COOK + H2O
C.所有高温条件下发生的反应
D.C6H12O6(葡萄糖)+ 6O2=== 6CO2 + 6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com