
����Ŀ�������£���ijһԪ��HA��Һ��NaOH��Һ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH���±���
ʵ���� | HA���ʵ���Ũ����mol��L��1�� | NaOH���ʵ���Ũ����mol��L��1�� | �����Һ��pH |
�� | 0.1 | 0.1 | pH��9 |
�� | c | 0.2 | pH��7 |
�� | 0.2 | 0.1 | pH<7 |
��1���ڢ���ʵ����0.1 mol��L��1HA��Һ��ˮ�ĵ���̶�Ϊa��0.1 mol��L��1NaOH��Һ��ˮ�ĵ���̶�Ϊb�����û����Һ��ˮ�ĵ���̶�Ϊc����a��b��c�ɴ�С��˳����_________��
��2���ڢ���ʵ����c_____0.2���<����������������
��3�����ݢ���ʵ�����õĻ����Һ������Һ������Ũ�ȴ�С����˳����____________��
��4�������£���֪KSP[Cu��OH��2]��2��10��20��ijCuSO4��Һ��c��Cu2������0.02 mol��L��1�����Ҫ����Cu��OH��2��������Ӧ������ҺpH����_________��
���𰸡���1��cab ��2���� ��3��c��A������c��Na������c��H������c��OH���� ��4��5
��������
�����������1����ʵ��ٵĽ�����������ǡ����ȫ��Ӧ�����Σ��Լ��ԣ�˵����Ϊ���ᣬ��ͬŨ�ȵ���ͼ���ˮ����̶��������д�����Һ����ˮ��ٽ�ˮ���룬����ˮ����̶ȵĹ�ϵΪcab����2�������ߵ�Ũ�ȵ�������ʱ��Һ��Ϊ���ԣ�������Ϊ���ԣ�˵��������������Ũ�ȴ��ڼ��Ũ�ȡ���3��ʵ����л�Ϻ�Ϊ��Ũ�ȵ�����ε���Һ����Һ�����ԣ�˵����ĵ���̶ȴ����ε�ˮ��̶ȣ�����ݵ���غ����������Ũ�ȹ�ϵΪc��A������c��Na������c��H������c��OH��������4��c��OH-��= ![]() mol/L������Һ��pH=5��
mol/L������Һ��pH=5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ԲȦ�ཻ�IJ��ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ����( )

A����Ӧ������ܲ���0.05molO2
B����Ӧ�������ӷ���ʽΪNa+2H2O=Na++2OH-+H2��
C������������������������ԭ��Ӧ
D��������������ַ�Ӧ��������Һ�����ʵ�������������>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ������Ҫ������
��1����֪��Ӧ2H2+O2 =2H2OΪ���ȷ�Ӧ����ͼ����ȷ��ʾ�÷�Ӧ�������仯���� ��

��ѧ�� | H��H | O��O | H��O |
����kJ/mol | 436 | 496 | 463 |
�Ӷϼ��ͳɼ��ĽǶȷ���������Ӧ�������ı仯����ѧ���ļ�����������������1molˮ���Էų�����____________kJ
��2��ԭ��ؿɽ���ѧ��ת��Ϊ���ܡ���������ͬ��ͭ����п���õ������Ӻ����CuSO4��Һ�У���Ƴ�ԭ��أ����������� , �����ķ�ӦʽΪ ���������Һ��SO42�� ���� �����������������һ��ʱ���ȡ��ϴ�����������������������Ϊ12.9 g��������ͨ���ĵ��ӵ����ʵ����� mol��
��3��һ���¶��£���3 molA�����1mol B����ͨ��һ�ݻ��̶�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)��B(g) ![]() xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ ��XΪ ������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ�� 0.8mol/L������ڣ�С�ڻ���ڡ�����
xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ ��XΪ ������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ�� 0.8mol/L������ڣ�С�ڻ���ڡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ������ͼ�Ԫ�صĻ����ﲻһ�����к�ǿ�Ļ�ԭ��
B. Ԫ�صĵ���һ������������ԭ��Ԫ�صĻ������Ƶ�
C. ������ֻ�ܵõ��ӱ���ԭ��������ֻ��ʧ���ӱ�����
D. �ڻ�ѧ��Ӧ�У��õ���Խ������������������Ծ�Խǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ���˵����ȷ����( )
A. ����ʹ���Ը��������Һ��ɫ
B. �����Ӿ���ƽ���������νṹ��12��ԭ����ͬһƽ���ϣ���λ�ϵ�4��ԭ����һ��ֱ����
C. ����ʹ��ˮ��ɫ���Ƿ�����ȡ����Ӧ
D. ��������̼̼˫���ʲ��ܷ����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ�������ڿ����л�Ϳ����е�ˮ������CO2��O2���ò��������⡱���á����⡱�׳ơ�ͭ�̡����ֳơ���ȸʯ��[��ѧʽΪCu2(OH��2CO3]����ͭ�̡��ܸ��ᷴӦ����ͭ�κ�CO2��H2O��ijͬѧ��������ϵ�з�Ӧʵ���ˡ�ͭ��ͭ�̡�������ͭ����ת����
![]()
��1�������ֲ�ͬ������ش�����ͭ�̡������������ʣ� _��
��2����д��ͭ�������ᷴӦ�Ļ�ѧ����ʽ�� ��
��3��д��B�Ļ�ѧʽ ��
��4������ת�����������ڻ��Ϸ�Ӧ���� �����ڸ��ֽⷴӦ���� (���������
��5��д���ٷ�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣 ��֪��
2SO2(g)+O2(g) 2SO3(g) ��H= -196.6kJ��mol��1
2NO(g)+O2(g)![]() 2NO2(g) ��H= -113.0kJ��mol-1
2NO2(g) ��H= -113.0kJ��mol-1
��ӦNO2(g)+SO2(g)![]() SO3(g)+NO(g)����H= kJ��mol-1
SO3(g)+NO(g)����H= kJ��mol-1
��2�����Ƕ�ֲ����������ȱ�ٵ�Ԫ�أ��ϳɰ��ķ�Ӧ����������ʳ�����Ӧ���£�
N2(g)��3H2(g)![]() 2NH3(g)��
2NH3(g)��
��һ�������£���һ������N2��H2�Ļ���������ij�����ܱ������У�һ��ʱ�������������˵���÷�Ӧ�ﵽƽ��״̬���� ������ţ���
A�������л��������ܶȲ���ʱ��仯 |
B������3 mol H-H����ͬʱ�γ�6 mol N-H�� |
C��N2��H2��NH3�����ʵ���֮��Ϊ1:3:2 |
D�������е�ѹǿ����ʱ��仯 |
��3����25 ����101 kPa�£�1 g�״�ȼ������CO2��Һ̬ˮʱ����22.68 kJ����÷�Ӧ���Ȼ�ѧ����ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д�����и��л���Ľṹ��ʽ��
��1����Է�������Ϊ114�������ף��������κ���̼ͬԭ������ϩ����H2�õ�����Ľṹ��ʽΪ____________��
��2����֪������A�뻯����B ��ת����ϵΪ��A![]() B���һ�����B�н���4��̼ԭ�ӡ�1����ԭ�ӡ�1����ԭ�ӣ���B�Ľṹ��ʽΪ____________��
B���һ�����B�н���4��̼ԭ�ӡ�1����ԭ�ӡ�1����ԭ�ӣ���B�Ľṹ��ʽΪ____________��
��3��ij��B����ʽΪCnH2n��2��������KMnO4��Һ������õ���
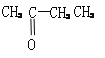 ��
��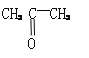 ��
��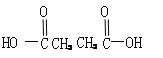
������Ľṹ��ʽΪ____________��
��4��ij��A����Է�������Ϊ84���ú�����ײ�֪�����к���̼̼˫�����ú˴Ź������������ʾֻ��һ�����͵���ԭ�ӡ���A�Ľṹ��ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��A��B��C��D��E��ԭ��������������A��Cͬ�壬B��D ͬ�壬C+��B3-������ͬ�ĵ��Ӳ�ṹ��A��B��D��E�����γɹ����ͻ����A��B�γɵĻ�������ˮ�гʼ��ԣ�C��E�γɵ�ԭ�Ӹ���Ϊ1:1�Ļ��������������ı���Ʒ���ش��������⣺
��1�� ����Ԫ���У�ԭ�Ӱ뾶������______���ǽ�������ǿ����______����Ԫ�ط��ţ���
��2 ����A��D��E���γɵĹ����ͻ������У����ȶ��Բ����________���û�ѧʽ��ʾ����
��3�� A��E�γɵĻ�������A��B�γɵĻ����ﷴӦ������Ļ�ѧʽΪ________��
���д��ڵĻ�ѧ������Ϊ________���õ���ʽ��ʾA��B���γɻ��������________��
��4�� D����������ˮ����Ļ�ѧʽΪ____________��
��5�� ����C�ڳ���ĵ���E��ȼ�գ���Ӧ�Ļ�ѧ����ʽΪ________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com