
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g。下列说法正确的是( )

A.反应③最多能产生0.05molO2
B.反应①的离子方程式为Na+2H2O=Na++2OH-+H2↑
C.①、②、③都属于氧化还原反应
D.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
【答案】A
【解析】
试题分析:A、反应③为2Na2O2+2H2O=4NaOH+O2↑,根据方程式知,0.1molNa2O2最多产生0.05molO2,故A正确;B、Na+2H2O═Na++2OH-+H2↑中电荷不守恒,反应①正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故B错误;C、氧化钠与水反应的方程式为Na2O+H2O=2NaOH,不属于氧化还原反应,故C错误;D、钠、氧化钠、过氧化钠和水反应的方程式分别如下:Na+H2O=NaOH+![]() H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;Na2O2+H2O=2NaOH+
H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;Na2O2+H2O=2NaOH+![]() O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g,所以溶液增加的质量大小顺序为:钠<氧化钠=过氧化钠,根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、分别溶于水所得溶液的质量分数分别为:
O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g,所以溶液增加的质量大小顺序为:钠<氧化钠=过氧化钠,根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、分别溶于水所得溶液的质量分数分别为:![]() 、
、![]() 、
、![]() ,所以①、②、③充分反应后所得溶液的质量分数从大到小:①<②=③,故D错误;故选A。
,所以①、②、③充分反应后所得溶液的质量分数从大到小:①<②=③,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】锰的单质及其化合物在生产、生活中有广泛应用。
(1)碱性锌锰电池广泛应用于日常生活。电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。该电池的正极反应式为 。
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
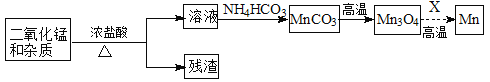
①加入浓盐酸溶解废旧电池内黑色物质过程中保持通风,其原因是 。
②从产品纯度、环保等角度考虑,X宜选择 (填代号)。
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 。
(3)电解硫酸锰溶液法制锰又叫湿法冶锰。以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:
![]()
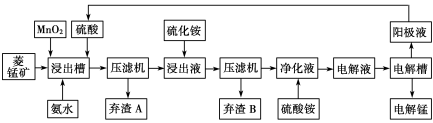
已知:NiS 、CoS均难溶于水。部分氢氧化物的pH如下表:(若某离子浓度小于等于105mol·L1,则认为完全沉淀)
物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
完全沉淀pH | 9.7 | 8.4 | 8.5 | 9.8 | 3.8 |
①浸出槽内MnO2的作用是(用离子方程式表示) 。
②加入氨水调节浸出槽中溶液的pH范围为 。
③电解槽阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关。下列说法不正确的是
A.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B.我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量
C.臭氧是氧化性极强的淡蓝色气体,可用作自来水的消毒剂
D.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代普 通DNA链中的P元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3 | Na2CO3 | 盐酸 | 加热 |
B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
C | I2 | H2O | 乙醇 | 萃取 |
D | H2O | Fe3+ | NaOH | 过滤 |
A.A、 B.B、 C.C、 D.D、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用化学杂志曾报道,有一种功能高分子材料为聚乙交酯纤维材料C,用这种功能高分子材料制成的手术缝合线比天然高分子材料的肠线好。它的合成过程如下:

(1)写出A的结构简式__________。
(2)写出由A制取B的化学方程式______________________________________________。
(3)可用作医用的高分子材料具备哪些特性?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是
A.反应A的△H>-115.6kJ·mol-1
B.H2O中H—O键比HCl中H—Cl键弱
C.由II中的数据判断氯元素的非金属性比氧元素强
D.断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
【方案一】
【实验方案】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是__________.
【实验步骤】
(1)称取10.8g铝镁合金粉末样品,溶于V mL 物质的量浓度为4.0mol/L NaOH溶液中,充分反应。则NaOH溶液的体积V≥______mL。
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将__________(填“偏高”、“偏低”或“无影响”).
【方案二】
【实验方案】将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积.
【实验步骤】
(1)同学们拟选用下列实验装置完成实验:
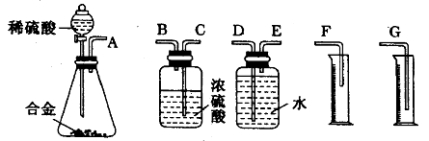
你认为最简易的装置其连接顺序是:A→( )→( )→( )→( )→( )(填接口字母,可不填满)。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
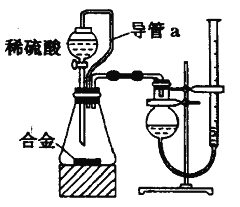
①与前面(1)中装置相比该装置中导管a的作用有 .
②实验中将碱式滴定管改装成量气管,且实验前后量气管中液面读数分别为V1 mL、V2 mL.则产生氢气的体积为__________mL。
③若需确定产生氢气的物质的量,还需测定的数据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)在①组实验中0.1 mol·L-1HA溶液中水的电离程度为a,0.1 mol·L-1NaOH溶液中水的电离程度为b,所得混合溶液中水的电离程度为c.则a、b、c由大到小的顺序是_________.
(2)在②组实验中c_____0.2(填“<”、“>”或“=”)
(3)根据③组实验所得的混合溶液,其溶液中离子浓度大小排列顺序是____________.
(4)常温下,已知KSP[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com