
【题目】化学与社会、生产、生活密切相关。下列说法不正确的是
A.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B.我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量
C.臭氧是氧化性极强的淡蓝色气体,可用作自来水的消毒剂
D.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代普 通DNA链中的P元素
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故。
(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是 。
(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式: 。
(3)常温下,0.1mol/L的NaClO溶液的PH=9.7,原因 。常温下HClO的电离平衡常数为 。洁厕液与84消毒液混合后会生成有毒的氯气。写出该反应的离子方程式 。
(4)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为 。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH;K2FeO4在水溶液中易水解:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)
4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)
a.水 b.NH4Cl、异丙醇 c.Fe(NO3)3、异丙醇 d.CH3COONa、异丙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO﹣、CN﹣、HCO3﹣、N2、Cl﹣六种物质,在反应过程中测得ClO﹣和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
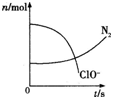
A.还原剂是CN﹣,氧化产物只有N2
B.氧化剂是ClO﹣,还原产物是HCO3﹣
C.配平后氧化剂与还原剂的计量系数之比为5:2
D.标准状况下若生成2.24LN2,则转移电子0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As的原子结构示意图为![]() ,则其在周期表中的位置是_____________。
,则其在周期表中的位置是_____________。
(2)N元素非金属性比As强,下列说法正确的是_______。
①NH3的热稳定性比AsH3差
②HNO3的酸性比H3AsO4强
③N的原子半径比As的原子半径小
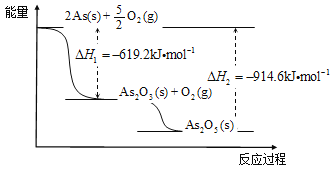
(3)根据下图写出As2O5分解为As2O3的热化学方程式____________________。
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:
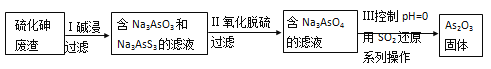
① As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应________(选填“是”或“不是”)氧化还原反应。
②过滤操作所用的玻璃仪器有_________________________。
③写出过程Ⅲ的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,将A逐滴加入B中:

(1)若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,则试管C中化学反应的化学方程式: 。然后往烧杯中加入沸水,可观察到试管C中的现象: 。
(2)若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解。当沉淀完全溶解,恰好变澄清时,关闭E然后往小试管中加入少量乙醛溶液,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是 (填名称),C是 (填化学式),与乙醛的混合后,该溶液中反应的化学方程式: 。实验结束时用 清洗银镜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙葵醛是一种常用香精,其结构简式为
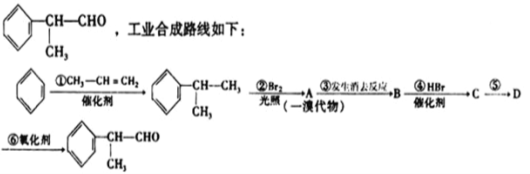
已知:苯的同系物与卤素单质反应时,若在光照条件下,侧链烃基上的氢原子被卤素原子取代;若在催化剂作用下,苯环某些位置上的氢原子被卤素原子取代。
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________。反应⑤的反应类型为
(2)有机化合物D可能具有的化学性质是___________(填写序号)。
a.水解反应 b.加聚反应 c.取代反应 d.消去反应
(3)检验龙葵醛中官能团的化学反应方程式为:_______________________。
(4)龙葵醛有多种同分异构体,试写出一种符合下列条件的同分异构体的结构简式 ___________。
①其水溶液遇FeCl3溶液呈紫色;②苯环上的一溴代物有两种;③分子中没有甲基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g。下列说法正确的是( )

A.反应③最多能产生0.05molO2
B.反应①的离子方程式为Na+2H2O=Na++2OH-+H2↑
C.①、②、③都属于氧化还原反应
D.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应具有重要意义。
(1)已知反应2H2+O2 =2H2O为放热反应,下图能正确表示该反应中能量变化的是 。

化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如右表:则生成1mol水可以放出热量____________kJ
(2)原电池可将化学能转化为电能。将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是 , 正极的反应式为 ,电解质溶液中SO42- 移向 极(填“正”或“负”)。一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com