
分析 (1)较活泼金属能够在溶液中置换出银,如锌、铁等,据此写出反应的化学方程式;
(2)氧化铁与强酸反应生成可溶性铁盐和水的离子反应为Fe2O3+6H+=2Fe3++3H2O,据此写出反应的化学方程式.
解答 解:(1)较活泼的金属能够与银离子反应生成锌离子和银单质,反应的离子方程式为:Zn+2Ag+=Zn2++2Ag,对应的化学方程式为:Zn+2AgNO3=Zn(NO3)2+2Ag,
故答案为:Zn;Zn2+;Zn+2AgNO3=Zn(NO3)2+2Ag;
(2)氧化铁与强酸反应生成可溶性铁盐和水的离子反应为:Fe2O3+6H+=2Fe3++3H2O,如:Fe2O3+6HNO3=2Fe(NO3)3+3H2O,
故答案为:6H+;3H2O;Fe2O3+6HNO3=2Fe(NO3)3+3H2O.
点评 本题考查离子反应方程式书写,为高频考点,题目难度中等,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应方程式的意义,该题答案不唯一.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 有氧元素参加的反应一定是氧化还原反应 | |
| B. | 反应前后元素化合价有变化的反应一定是氧化还原反应 | |
| C. | 氧化还原反应中,一种物质被氧化,必然有另一种物质被还原 | |
| D. | 有单质生成或有单质参加反应的化学反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成Cu的物质的量是0.1mol | B. | 随着电解的进行溶液的c(H+)增大 | ||
| C. | 转移电子的物质的量是0.2mol | D. | 阳极反应式是4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O | |
| B. | CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O | |
| C. | CH3-CH=CH2+Br2→CH3-CHBr-CH2Br | |
| D. | 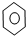 +Br2 $\stackrel{Fe}{→}$ +Br2 $\stackrel{Fe}{→}$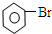 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ca2+、Cl-、CO32- | B. | Na+、Fe3+、SO42-、OH- | ||
| C. | Cu2+、Ba2+、Cl-、SO42- | D. | K+、Na+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④ | C. | ①⑤ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com