
����Ŀ������������ʵ�ķ���ʽ��ȷ������������
A. ��ú�м���ʯ��ʯ�ɼ���úȼ��ʱSO2���ŷ���2CaCO3+O2+2SO2![]() 2CO2+2CaSO4
2CO2+2CaSO4
B. ���ȿ���ǿ������Һȥ��������CO32�� + 2H2O H2CO3 + 2OH��
C. �ô�����Һ��ˮ���е�CaCO3��CaCO3 + 2H+ = Ca2+ + H2O + CO2��
D. ̼��������Һ����������ʯ��ˮ��ϳ��ְ�ɫ������CO32��+ Ca2+ = CaCO3��
���𰸡�A
��������A����ú�м���ʯ��ʯ�ɼ���úȼ��ʱSO2���ŷţ�2CaCO3+O2+2SO2![]() 2CO2+2CaSO4����A��ȷ��B���ε�ˮ��Ϊ���ȷ�Ӧ�����ȿɴٽ�����ˮ�⣬��Һ������ǿ��ȥ��������ǿ����ȷ�����ӷ���ʽΪ��CO32��+H2O HCO3��+OH������B����C��̼������ܺʹ����ѵ��룬�����ӷ���ʽ�ж����ܲ���ȷ�����ӷ���ʽΪ��CaCO3+2CH3COOH=Ca2��+H2O+CO2��+2CH3COO������C����D��̼��������Һ����������ʯ��ˮ��ϳ��ְ�ɫ���������ӷ���ʽ��������������Ca2�� ��OH�D ���ʵ���֮��Ϊ1��2��д����ȷ�����ӷ���ʽΪCa2��+2HCO3��+2OH��=CO32��+CaCO3��+2H2O����D����ѡA��
2CO2+2CaSO4����A��ȷ��B���ε�ˮ��Ϊ���ȷ�Ӧ�����ȿɴٽ�����ˮ�⣬��Һ������ǿ��ȥ��������ǿ����ȷ�����ӷ���ʽΪ��CO32��+H2O HCO3��+OH������B����C��̼������ܺʹ����ѵ��룬�����ӷ���ʽ�ж����ܲ���ȷ�����ӷ���ʽΪ��CaCO3+2CH3COOH=Ca2��+H2O+CO2��+2CH3COO������C����D��̼��������Һ����������ʯ��ˮ��ϳ��ְ�ɫ���������ӷ���ʽ��������������Ca2�� ��OH�D ���ʵ���֮��Ϊ1��2��д����ȷ�����ӷ���ʽΪCa2��+2HCO3��+2OH��=CO32��+CaCO3��+2H2O����D����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ʵ��������������ó��Ľ�����ȷ����
ѡ �� | ʵ����� | ʵ������ | �� �� |
A | ��NaHS��Һ�е����̪ | ��Һ���ɫ | HS��ˮ��̶ȴ��ڵ���̶� |
B | ��Ũ�Ⱦ�Ϊ0.1 mol��L��1��MgCl2��CuCl2�����Һ����μ��백ˮ | �ȳ�����ɫ���� | Ksp[Mg��OH��2]��Ksp[Cu��OH��2] |
C | ��Na2CO3��Һ�м���Ũ���ᣬ������������ͨ�뱽������Һ�� | ������ɫ���� | ���ԣ����̼����� |
D | ��ʢ��KI3��Һ�����Թ��зֱ���������Һ��AgNO3��Һ | ǰ����Һ����ɫ�������л�ɫ���� | KI3��Һ�д��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ijͬѧ�����һ�����ѣ�CH3OCH3��ȼ�ϵ�ز�̽���ȼҵԭ����ԭ���ʹ�ͭ�ľ���ԭ������װ����XΪ�����ӽ���Ĥ������Ҫ��ش�����������⣺

��1��ͨ�������ĵ缫Ϊ_____(��������������������)��д�������ĵ缫��Ӧʽ_____��
��2�����缫Ϊ_____(��������������������)��ʯī�缫�ĵ缫��ӦʽΪ_____��
��3����Ӧһ��ʱ�����װ��������NaOH��Ҫ��_____(��������������ʯī����)����
��4�������ͭ�к���п���������ʣ���װ���������ϵ缫��ӦʽΪ_____����Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ�_____(��������������С������������)��
��5�����ڱ�״���£���2.24L�����μӷ�Ӧ������װ�������缫�����ɵ������ڱ�״���µ����Ϊ_____����װ������������ͭ������Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������NaOH��������1.00 mol��L��1��NaOH��Һ100 mL�����������ҺŨ��ƫ�͵�ԭ����(����)
A. ��¶�ڿ����г���NaOH��ʱ��̫��
B. ������ƿת��Һ��ʱ������ƿ�ں�������ˮ
C. ����ʱ���ӿ̶���
D. �ܽ��δ��ȴ�����¾�ת��������ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����п���֤��A(s)+2B2(g)![]() 2C2(g)+D2(g)�Ѿ��ﵽƽ��״̬����
2C2(g)+D2(g)�Ѿ��ﵽƽ��״̬����
�ٵ�λʱ����������2molC2��ͬʱҲ������1molA
��һ��B��B���Ķ��ѵ�ͬʱ��һ��C��C��������
�۷�Ӧ����v(B2)=v(C2)=1/2v(D2)
��c(B2):c(C2):c(D2)=2:2:1
���¶ȡ����һ��ʱ��B2��C2��D2Ũ�Ȳ��ٱ仯
���¶ȡ����һ��ʱ�������ڵ�ѹǿ���ٱ仯
���ھ���װ���У���ϵ���¶Ȳ��ٱ仯
���¶ȡ����һ��ʱ�����������ܶȲ��ٱ仯
��ٷ����B2%=C2%=D2%
A. �٢ۢޢ� B. �ڢܢߢ� C. �٢ݢޢߢ� D. �٢ݢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Ȼ�þ��Һ���ܶ�Ϊ1.18g/cm3�������Ȼ�þ����������Ϊ47.5%��100mL����Һ�������ӵ����ʵ������ڣ� ��
A. 0.59mol B. 0.295mol C. 1.18mol D. 2.36mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã��û�ѧ����ش��������⣺ 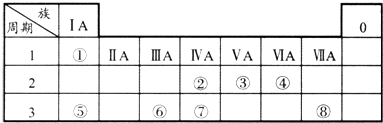
��1���ܢݢļ����Ӱ뾶�ɴ�С��˳��Ϊ�������ӷ��ţ���
��2���ڢۢߵ���ۺ������������ǿ������˳�������ѧʽ����
��3���ܺ͢ݵĵ��ʳ��¿��Է�Ӧ���ɻ�����A���õ���ʽ��ʾ������A���γɹ���
��4���٢ܢݢ��е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ����д������һ�ֻ�����ĵ���ʽ ��
��5���ɢ٢�����Ԫ���γɳ���Һ̬������û������ʹ���Ը��������Һ��ɫ��д�������ӷ���ʽ ��
��6���ɱ���Ԫ���γɵij�������X��Y��Z��M��N�ɷ������·�Ӧ�� 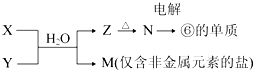
X��Һ��Y��Һ��Ӧ�����ӷ���ʽΪ �� �������ʢ�������ʵ��������������������Һ��Ӧ�������������ʵ���֮��Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5L 1mol/L FeCl3��Һ��0.5L 1mol/L KCl��Һ�е�Cl������Ŀ֮��
A. 5��2 B. 3��1 C. 15��2 D. 1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ���ǣ� ��
A. ����һ�ֵ���ɫ��������ˮ�Ĺ���
B. ��Ļ����ﳣ�����ڻ�ɽ�������
C. �����ŷŶ�������ᵼ��������γ�
D. ���ڿ����е�ȼ�ղ����Ƕ��������ڴ����е�ȼ�ղ�������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com