
����Ŀ����NA���������ӵ�������������Ȼ�ѧ����ʽC2H2(g)��![]() O2(g)=2CO2(g)��H2O(l) ��H����1300 kJ/mol ��˵���У���ȷ����( )
O2(g)=2CO2(g)��H2O(l) ��H����1300 kJ/mol ��˵���У���ȷ����( )
A����ת��10NA������ʱ���÷�Ӧ�ų�1300 kJ������
B����1NA��ˮ����������ΪҺ��ʱ������1300 kJ������
C����2NA��̼�����õ��Ӷ�����ʱ���ų�1300 kJ������
D����8NA��̼�����õ��Ӷ�����ʱ���ų�1300 kJ������
 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���������������ЧӦ����
A. ϡ���� B. ���۽��� C. �Ȼ�����Һ D. ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�����ڴ�������ǣ�������
A. C4H10 B. ����ϩ C. ���� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ���������Ԫ��W��X��Y��Z��ԭ��������������W��X�ļ����Ӿ�����ͬ���Ӳ�ṹ��X��ԭ�Ӱ뾶�Ƕ���������Ԫ��ԭ�������ģ�W��Yͬ�壬Z��X�γɵ����ӻ������ˮ��Һ�����ԡ�����˵����ȷ����(����)
A. W��X�γɵĻ���������ˮ����Һ�ʼ���
B. �����Ӱ뾶��W<X<Z
C. ��̬�⻯������ȶ��ԣ�W<Y
D. ����������ˮ��������ԣ�Y>Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���ĽṹΪ 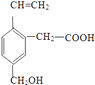 �������л��ﲻ���ܾ��е������ǣ� ��
�������л��ﲻ���ܾ��е������ǣ� ��
A.�ܸ�NaOH��Һ��Ӧ
B.��ʹ����KMnO4��Һ��ɫ
C.�ܷ���������Ӧ
D.�ܷ���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ��д�������(����)
A. Ca(OH)2��CaOH����OH��
B. HCl��H����Cl��
C. Ba(NO3)2��Ba2����2NO3��
D. NaOH��Na����OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���10 mL 0.40 mol��L-1 H2O2��Һ�м�������FeCl3��Һ����ͬʱ�̲������O2�������������Ϊ��״�������±���ʾ��
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
������ʾ����Ӧ���������У�
��2Fe3++ H2O2 ![]() 2Fe2++O2��+2H+
2Fe2++O2��+2H+
�� H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
��Ӧ�����������仯����ͼ��ʾ������˵������ȷ����

A. 0��6 min��ƽ����Ӧ���ʣ�v(H2O2) = 3.33��10-2 mol��L-1��min-1
B. Fe3+�������Ǽӿ��������ķֽ�����
C. ��Ӧ�������ȷ�Ӧ����Ӧ���Ƿ��ȷ�Ӧ
D. ��Ӧ2H2O2(aq)![]() 2H2O(l) + O2(g)�ġ�H =E1-E2 < 0
2H2O(l) + O2(g)�ġ�H =E1-E2 < 0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˳������ȷ����
A. ʧ����������Na��K B. ���ԣ� NaOH��KOH
C. �õ���������S��Cl D. ���ԣ� HClO4��H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������β���dz�����Ҫ������Ⱦ��о���������β����Ϊ������������Ҫ����
��1��������ȼ������ʱ������Ӧ��N2(g) + O2(g)![]() 2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T ��ʱ����һ����̶����ܱ������г���6.5mol N2��7.5mol O2����5 minʱ��Ӧ�ﵽƽ��״̬����ô�ʱ������NO�����ʵ���Ϊ5mol��
2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T ��ʱ����һ����̶����ܱ������г���6.5mol N2��7.5mol O2����5 minʱ��Ӧ�ﵽƽ��״̬����ô�ʱ������NO�����ʵ���Ϊ5mol��
�ٷ�Ӧ��ʼ���ﵽƽ��Ĺ����У����������и�����仯����___������ţ���
a.���������ܶ� b.��������ѹǿ
c.����Ӧ���� d.��λʱ���ڣ�N2��NO��������֮��
�ڼ����������Ϊ5L����5min�ڸ÷�Ӧ��ƽ��������(NO) =___��
��2��H2��CO���Դ���ԭNO�Դﵽ������Ⱦ��Ŀ�ġ�
����֪��N2(g) + O2(g) = 2NO(g) ��H= +180.5 kJ��mol-1
2H2(g) + O2(g) = 2H2O(l) ��H=��571.6 kJ��mol-1
��H2(g)��NO(g)��Ӧ����N2(g)��H2O(l)���Ȼ�ѧ����ʽ��___���жϸ÷�Ӧ�Է����е�������___��
�ڵ�����һ��ʱ�������������ı���������ѧ��Ӧ���ʡ���ͼ��ʾ��������������ʱ����Ӧ��2NO(g) + 2CO(g)![]() 2CO2(g) + N2(g)��NO��Ũ��[c(NO)]���¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߡ���÷�Ӧ����H___0�����������������������������ı����S1��S2 ���ڸ�ͼ�л���c(NO)��T1�� S2�����´ﵽƽ������еı仯����___��
2CO2(g) + N2(g)��NO��Ũ��[c(NO)]���¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߡ���÷�Ӧ����H___0�����������������������������ı����S1��S2 ���ڸ�ͼ�л���c(NO)��T1�� S2�����´ﵽƽ������еı仯����___��
��3��ijС����һ���º�ѹ��������9mol N2��23mol H2ģ��ϳɰ���Ӧ��ͼCΪ��ͬ�¶���ƽ�������а����������������ѹǿ��p���Ĺ�ϵͼ������ϵ��T2��60MPa�´ﵽƽ�⣮

�����ж�N2��g��+3H2��g��2NH3��g���ﵽƽ�����___������ţ���
a��������ѹǿ���ٷ����仯 b�����������ܶȲ��ٷ����仯
c��v����N2��=3v����H2�� d����������ƽ����Է����������ٷ����仯
�ڴ�ʱN2��ƽ���ѹΪ__MPa������ѹ=��ѹ�����ʵ������������������ʱ��ƽ�ⳣ��Kp=___����ƽ���ѹ����ƽ��Ũ�ȼ��㣬�������2λ��Ч���֣���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com