

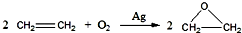
分析 (一)物质制备中原子利用率越高越好;
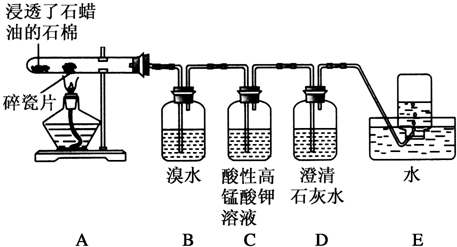
(二)探究工业制乙烯的原理和乙烯的主要化学性质,由实验装置可知,A中烷烃在催化剂和加热条件下发生反应生成不饱和烃,B中乙烯与溴水发生加成反应,C中乙烯与高锰酸钾发生氧化反应,D中吸收C中生成的二氧化碳,E中利用排水法收集乙烯.
(1)结合原子守恒分析分子式,乙为乙烯;
(2)B中乙烯与溴水反应;
(3)C中乙烯与高锰酸钾反应;
(4)D中石灰水变浑浊可说明C中反应,探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱性,因加成产物只有卤代烃,而取代产物中有HBr;
(5)乙烯含双键、与溴水、高锰酸钾反应,而甲烷不能,除杂时不能引入新杂质;
(6)有机物含碳量越高,燃烧火焰越明亮,烟越浓.
解答 解:(一)根据绿色化学知,原子利用率越高越好,根据反应方程式知,乙中原子利用率100%,高于甲,所以乙好,故答案为:乙;
(二)探究工业制乙烯的原理和乙烯的主要化学性质,由实验装置可知,A中烷烃在催化剂和加热条件下发生反应生成不饱和烃,B中乙烯与溴水发生加成反应,C中乙烯与高锰酸钾发生氧化反应,D中吸收C中生成的二氧化碳,E中利用排水法收集乙烯.
(1)由C16H34$→_{△}^{催化剂}$C8H18+甲,甲$→_{△}^{催化剂}$4乙及原子守恒可知甲为C8H16,乙为CH2═CH2,故答案为:C8H16;CH2═CH2;
(2)B装置中的实验现象可能是橙色(或橙黄色)褪去,反应的化学方程式为CH2═CH2+Br2→BrCH2-CH2Br,其反应类型是,
故答案为:橙色(或橙黄色)褪去;CH2═CH2+Br2→BrCH2-CH2Br;加成反应;
(3)C装置中可观察到的现象是紫色(或紫红色)褪去,反应类型是氧化反应,
故答案为:紫色(或紫红色)褪去;氧化反应;
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳.根据本实验中装置D中的实验现象(石灰水变浑浊)可判断该资料是否真实.为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱性,简述其理由为若乙烯与溴发生取代反应生成HBr,其溶液酸性会显著增强,
故答案为:D;若乙烯与溴发生取代反应生成HBr,其溶液酸性会显著增强;
(5)A.气体通入水中,二者均与水不反应,不能除杂,也不能鉴别;
B.气体通过盛溴水的洗气瓶,乙烯与溴水反应,而甲烷不能,可鉴别,也可除去甲烷中的乙烯;
C.气体通过盛酸性高锰酸钾溶液的洗气瓶,乙烯与高锰酸钾反应,而甲烷不能,可鉴别,但反应生成二氧化碳,引入新杂质,不能除杂;
D.气体通过氢氧化钠溶液,二者均不反应,不能除杂,也不能鉴别.
故答案为:BC;B;
(6)有机物含碳量越高,燃烧火焰越明亮,烟越浓,乙烯中碳的质量分数为85.7%,大于甲烷中碳的质量分数(75%),所以分别燃烧乙烯和甲烷,甲烷火焰明亮而乙烯产生少量黑烟,
故答案为:乙烯中碳的质量分数为85.7%,大于甲烷中碳的质量分数(75%).
点评 本题考查探究物质的组成及物质的性质,为高频考点,侧重考查学生实验操作及实验探究能力,明确物质性质及其性质差异性是解本题关键,利用物质差异性鉴别物质,注意:甲烷中含有乙烯不能用酸性高锰酸钾溶液除杂,为易错点.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | 只有③ | D. | 只有① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在点燃易燃气体前,必须检验气体的纯度 | |
| B. | 在稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌 | |
| C. | 浓酸对皮肤有腐蚀性,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸稀溶液 | |
| D. | 不得点燃添满酒精的酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在 | |
| B. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 | |
| C. | 加入Ba(NO3)2,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在 | |
| D. | 用洁净的铂丝蘸取溶液放在火焰上灼烧,观察到火焰呈黄色,可确定有Na+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②③④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+[:$\underset{\stackrel{••}{Cl}}{••}$:]2- | B. | Na+[$\stackrel{•}{X}$$\underset{\stackrel{••}{S}}{••}$$\stackrel{•}{X}$]-2Na+ | ||
| C. | [Mg2+][$\underset{X}{•}$$\underset{\stackrel{••}{O}}{••}$$\underset{X}{•}$]2- | D. | K+[$\stackrel{•}{X}$$\underset{\stackrel{••}{F}}{••}$:]- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com