
短周期主族元素A、B、C、D的原子序数依次增大。A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.非金属性:A>C
B.原子半径:B<C<D
C.最高价氧化物对应水化物的酸性:D<C
D.单质B常温下能溶于浓硝酸
A
解析试题分析:短周期主族元素A、B、C、D原子序数依次增大,B原子最外层电子数等于A原子最外层电子数的一半,则A原子最外层电子数为偶数,A、C的原子序数的差为8,则A、C为同主族元素,A、B、C三种元素原子的最外层电子数之和为15,令B原子最外层电子数为x,则x+2x+2x=15,解的x=3,故A、C的最外层电子数为6,A为O元素,C为S元素,B的原子序数大于氧元素,最外层电子数为3,故B为Al元素,D的原子序数最大,故D为Cl元素,A、同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Al>S>Cl>O,即B>C>D>A,故B错误;B、同主族自上而下非金属性增强,非金属性O>S,故A正确;最高价氧化物对应水化物的酸性:氯大于硫,C错误;铝 常温下与浓硝酸发生钝化,不能溶解,错误;
考点:本题考查结构位置性质关系,难度中等,注意利用奇偶性及A、C的原子序数相差8判断二者处于同一主族(短周期),是推断元素关键。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.N和As属于第VA族元素,N原子得电子能力比As原子强 |
| B.族序数等于其周期序数的元素一定是金属元素 |
| C.元素周期表中,位于金属和非金属交界线附近的元素属于过渡元素 |
| D.Si、S、Cl的最高价氧化物都能与水反应生成相应的酸,且酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子 B.1H与D互称同位素
C.H2O与D2O互称同素异形体 D.1H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z、Q在元素周期表中的相对位置如下图:地壳中含量最大的三种元素已包含其中。关于这些元素的叙述不合理的是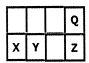
| A.最高价氧化物对应水化物的酸性Z>Y |
| B.原子半径X>Y |
| C.一定条件下,Q可分别与X、Y、Z形成化合物,这些化合物都可溶于NaOH溶液 |
| D.元素Y的氧化物是形成酸雨的罪魁祸首 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
两种短周期元素X和Y形成的单质能与氢气反应生成HX和HY,反应热分别为Q1和Q2,已知Q1>Q2,,则判断一定正确的是
| A.沸点:HY>HX | B.还原性:HY>HX |
| C.稳定性:HY>HX | D.酸性:HXO4>HYO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、M、N代表五种金属,有以下化学反应:
①水溶液中:X+Y2+=X2++Y;
②Z+2H2O(冷)=Z(OH)2+H2↑;
③M、N为电极与N盐溶液组成原电池,负极反应为:M-2e-=M2+;
④Y可以溶于稀H2SO4中,M不能被H2SO4氧化,则这五种金属的活动性由弱到强的顺序是
| A.M<N<Y<X<Z | B.N<M<Y<X<Z |
| C.N<M<X<Y<Z | D.X<Z<N<M<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y为短周期元素,X位于ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
| C.两元素形成的化合物中,原子个数比不可能为1∶1 |
| D.X2Y可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X和Y属短周期元素,X原子的最外层电子数是次外层的2倍,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的分子式可表示为( )
| A.XY | B.XY2 | C.Y3X | D.XY4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素的原子结构决定其性质和在周期表中的位置,下列说法中正确的是( )
A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
B.某微粒的结构示意简图为 ,则该元素在周期表中位于第三周期、ⅥA族
,则该元素在周期表中位于第三周期、ⅥA族
C.过氧化氢电子式:
D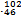 Pd和
Pd和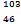 Pd互为同位素
Pd互为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com