
(1)若该混合液中只含有两种组分,则所有可能的组合是________。
(2)若该混合液中含有三种组分,且知在628g该混合液中有1mol H2O,则此时乙醇和乙醚的物质的量各是多少?
| (1)乙醚和乙醇,乙醚和水。
(2)乙醚7mol,乙醇2mol。 解析:(1)C4H10O、C2H6O、H2O中的n(H)︰n(O)分别为10︰1、6︰1、2︰1、,混合物中n(H)︰n(O)=8.5︰1,则组分中n(H)︰n(O)有大于8.5︰1的,也有小于8.5︰1的,因此,混合液有两种可能:乙醚和水、乙醚和乙醇。 (2)为计算方便,把该混合物写成C16H42O5,则1mol该有机物的质量为314g,628g该有机物即为2mol,即含32mol C、84mol H、10mol O。 设628g混合物中含a mol C4H10O、bmol C2H6O,并已知n(H2O)=1 mol, 有 则乙醚为7 mol,乙醇为2mol。
|


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:阅读理解
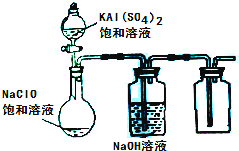 (2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.
(2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省达州市高三第一次诊断性考试理综化学试卷(解析版) 题型:填空题
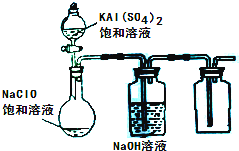
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为
电解后的溶液PH 7(填大于、小于、等于);其原因是 (用离子方程式表示)
(2)KAl(SO4)2溶液中质子守恒等式为
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。

①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。此时反应的离子方程式为
。
②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体。写出在光照射下混合液中反应的化学方程式是 。
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4·FeSO4)溶液,其他不变。打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液。观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生。此时烧瓶中发生的氧化还原反应的离子方程式为
。
(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为 (忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10-12)
查看答案和解析>>
科目:高中化学 来源:达州一模 题型:问答题
查看答案和解析>>
科目:高中化学 来源:临沂三模 题型:问答题
| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com