
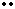 (2)
(2)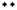

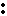
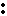



 Na + S + Na Na S Na
Na + S + Na Na S Na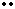
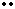 (2分)
(2分)

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| | 实 验 事 实 | 结 论 |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| C | 将Na2CO3溶液与苯酚浊液混合溶液变澄清 | 酸性:苯酚>HCO3- |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.它处在元素周期表中第二周期ⅤA族 | B.它的最高正价为+5,负价为-3 |
| C.它的最高价氧化物对应水化物是一种强酸 | D.它的非金属性比磷弱比氧强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.是银白色、质软的金属 | B.能形成+3价的化合物 |
| C.Tl(OH)3是两性氢氧化物 | D.能与硝酸反应生成硝酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com