
【题目】用酸性KMnO4溶液不能达到预期目的的是
A.区别苯和甲苯
B.检验硫酸铁溶液中是否有硫酸亚铁
C.检验CH2=CHCHO中含碳碳双键
D.区别SO2和CO2
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】下列物质的熔沸点高低比较正确的是( )
A.邻二甲苯( ![]() )、邻羟基苯甲醛(
)、邻羟基苯甲醛( ![]() )熔沸点均于其对应对位取代物
)熔沸点均于其对应对位取代物
B.卤素元素的单质及其氢化物的熔沸点随原子半径的增大而升高
C.石墨、金刚石、碳化硅、晶体硅、白磷、水、干冰熔沸点依次降低
D.NaCl、MgCl2、MgO,Al2O3熔沸点依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,隔板K可左右移动,甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处.发生反应2A(g)+B(g)2C(g),达到平衡后,恢复至温度.下列有关说法不正确的是
( )
A.达平衡后,隔板K最终停留在左侧刻度0~2之间
B.若平衡时K停留在左侧1处,则活塞停留在右侧6处
C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量
D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A﹣ , 在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,已知25℃时,HA、H2CO3的电力平衡常数分别为K=6.25×10﹣5、K1=4.3×10﹣7 , 下列说法正确的是(不考虑饮料中其他成分)( )
A.提高CO2充气压力,饮料中c(A﹣)不变
B.当pH为5.0时,饮料中 ![]() =0.16
=0.16
C.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D.结合H+的能力:A﹣>HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属加工后的废切削液中含2%~3%的NaNO2,它是一种环境污染物,人们用NH4Cl溶液来处理废切削液,使NaNO2转化为无毒物质,该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2
第二步:NH4NO2=N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2只是氧化剂 ②NH4NO2只是还原剂
③NH4NO2发生了分解反应 ④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④ C. ②③④ D. ③④⑤
【答案】D
【解析】本题考查氧化还原反应的基本概念。第二步反应中NH4NO2发生了自身的氧化还原反应,其中氮元素发生了归中反应,NH4NO2既是氧化剂又是还原剂,从四大基本反应类型看,NH4NO2发生的是分解反应,所以③④⑤是正确的。故D选项符合题意。
【题型】单选题
【结束】
16
【题目】下图表示AlCl3溶液与NaOH溶液相互滴加混合,由图中判断错误的是( )
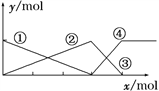
A. ①线表示Al3+物质的量的变化
B. x表示AlCl3的物质的量
C. ③线表示Al(OH)3物质的量的变化
D. ④线表示AlO![]() 物质的量的变化
物质的量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分利用已有的数据是解决化学问题方法的重要途径.对数据的利用情况正确的是
A.利用化学平衡常数判断化学反应进行的快慢
B.利用溶解度数据判断氧化还原反应发生的可能性
C.利用沸点数据推测将一些液体混合物分离的可能性
D.利用物质的摩尔质量判断相同状态下不同物质密度的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol,它由两步反应组成:
i.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ/mol
ii.SO3(g)分解.
(1)SO3(g)分解的热化学方程式为
(2)工业上常用SO2制备Na2S2O3 , 向0.1mol/L的Na2S2O3溶液中滴加稀硫酸的离子方程式为 .
(3)反应ii的△S0 (填“>”、“<”、“=”).
(4)对反应ii,可用V2O5作催化剂. 已知:SO2+V2O5SO3+V2O4K1、 ![]() O2+V2O4V2O5K2 , 则在相同温度下,2SO3(g)2SO2(g)+O2(g)的平衡常数 K=(用K1、K2表示).
O2+V2O4V2O5K2 , 则在相同温度下,2SO3(g)2SO2(g)+O2(g)的平衡常数 K=(用K1、K2表示).
(5)L(L1、L2),X可分别代表压强或温度,如图表示L一定时,反应ii中SO3(g)的平衡转化率随X的变化关系. 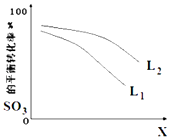
①X代表的物理量是;
②比较L1、L2的大小 .
(6)维持体系总压p恒定,在T℃时,物质的量为9mol、体积为2L的SO3(g)发生反应:2SO3(g)2SO2(g)+O2(g),已知SO3的平衡转化率25%,则在该温度下反应的平衡常数K=(用最简分数表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在50mL NaNO3和Na2SO4的混合溶液中,c (Na+)=1mol/L,往其中加入适量BaCl2溶液恰好完全反应,得到2.33g白色沉淀,则原混合溶液中c (NO3﹣)=mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com