
| A. | HC的电离度最大 | |
| B. | HA溶液酸性最强 | |
| C. | HC溶液酸性最强 | |
| D. | 三种溶液中酸的电离程度:HA<HB<HC |
科目:高中化学 来源: 题型:选择题
| A. | 可将固体或浓溶液直接在容量瓶中溶解或稀释 | |
| B. | 氯化钠溶解于水,形成能够自由移动的水合钠离子和水合氯离子 | |
| C. | 失去电子越多的氧化剂,其氧化性就越强 | |
| D. | 物质的量浓度相等的盐酸和醋酸,导电能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C1>C2 | B. | 2C1=C2 | C. | 2C1<C2 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质焰色反应呈黄色,结论:该物质一定是钠盐 | |
| B. | 无色盐溶液中加入NaOH溶液,加热后产生的气体能使湿润的红色石蕊试纸变蓝,结论:原溶液中一定含有NH4+ | |
| C. | 无色溶液中加入BaCl2溶液,有白色沉淀产生,再加稀硝酸,沉淀不消失,结论:原溶液一定含有SO42- | |
| D. | 无色溶液中加入稀盐酸,产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
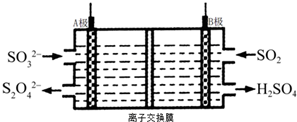
| A. | A电极接电源的正极 | |
| B. | A极区溶液的碱性逐渐增强 | |
| C. | 本装置中使用的是阴离子交换膜 | |
| D. | B极的电极反应式为SO2+2e-+2H2O═SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易燃试剂与强氧化试剂分开放置并远离火源 | |
| B. | 用湿润的红色石蕊试纸检验氨气 | |
| C. | 在50ml量筒中配制0.1000mol•L-1硫酸钠 | |
| D. | 实验室酒精灯着火时,用湿抹布覆盖灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
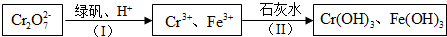
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | 盐酸 | C. | 醋酸 | D. | 硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气反应生成氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| B. | 将溴水加入苯中,溴水褪色是因为发生了加成反应 | |
| C. | 油脂和蛋白质都可以发生水解反应 | |
| D. | 乙醇、苯、乙酸均可发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com