
【题目】氮(N)、磷(P)、砷(As)等都是VA族元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)As原子的价电子排布式为____________。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是________________。
(3)NH4+中H—N—H的键角比NH3分子中的键角________(填“大”或“小”),原因是____________。
(4)NaAsO4中含有的化学键类型包括__________;AsO43-的空间构型为_____________;As4O6的分子结构如下图所示,则在该化合物中As原子的杂化方式是____________。

(5)2017年1月27日,我国科学家在《Science》杂质上发表论文,在全氮阴离子盐合成上取得重大进展,首次制得试问下稳定,含有N5-离子的盐(具有超高能量密度的化合物),N5-离子中氮元素的平均化合价为_____。
(6)白磷(P)的晶体属于分子晶体,其晶胞结构如下图(小圆圈表示白磷分子)。该晶胞中含有的P原子数为_______;已知该晶胞的边长为a cm,阿伏加德罗常数为NAmol-1,则该晶体的密度为_____g·cm-3(用含有NA的式子表示)

【答案】 4s24p3 P的3p轨道是半充满状态,比较稳定,所以第一电离能比硫的大 大 NH![]() 中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力 离子键、共价键 正四面体 sp3 -
中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力 离子键、共价键 正四面体 sp3 -![]() 16
16 ![]()
【解析】(1)As位于第四周期第VA族,原子的价电子排布式为4s24p3。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是P的3p轨道是半充满状态,比较稳定,所以第一电离能比硫的大。
(3)NH4+中H—N—H的键角比NH3分子中的大,原因是NH![]() 中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力。
中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力。
(4)NaAsO4中含有的化学键类型包括离子键、共价键;AsO43-中中心原子的价电子对数为4对,所以其空间构型为正四面体;As4O6中As原子连接3根化学键,所以杂化方式是sp3。
(5)根据化合价规则,5个N原子总共为-1价,所以N5-离子中氮元素的平均化合价为- ![]() 价。
价。
(6)每1个白磷分子含4个P原子,该晶胞中含有4个白磷分子,所以P原子数为16;晶体的密度=晶胞质量÷晶胞体积=![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知-C6H5 代表苯基,下列卤代烃在 KOH 醇溶液中加热能发生消去反应的有( )种
① C6H5Br ②CH3Cl ③(CH3)3CCH2Cl ④C6H5CH2Br ⑤ CHCl2-CHBr2 ⑥(CH3)3CCl
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Na、Mg、Al的有关性质的叙述正确的是:
A. 碱性:NaOH< Mg(OH)2< Al(OH)3 B. 第一电离能:Na< Mg <Al
C. 电负性:Na> Mg >Al D. 还原性:Na> Mg >Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关自然资源的开发利用的叙述正确的是
A. 通过催化重整,可从石油中获取环状烃
B. 金属铝的冶炼可采取电解熔融氯化铝的方法
C. 石油的裂化和裂解属于化学变化而煤的液化、气化属于物理变化
D. 煤中含有的苯、甲苯、二甲苯等有机物,可通过煤的干馏来获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________________________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂发生Cl2泄漏,以下应对措施中主要是基于Cl2的物理性质考虑的是
A. 向被污染的土壤洒石灰
B. 向远离污染源的高处撤离
C. 用浸有纯碱溶液的毛巾捂住口鼻迅速撤离
D. 来不及撤离时可用纯碱溶液浸湿的棉被堵好门窗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为几种晶体或晶胞的示意图:
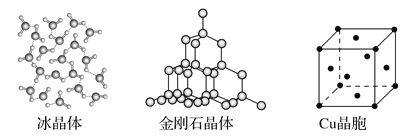
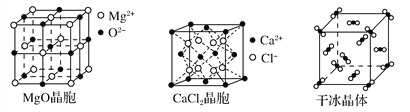
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为________________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能______(填“大于”或“小于”)MgO晶体,原因是________________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是

A. 电极Y为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com