
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是

a(干燥气体) | b(液体) | |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③ B. ①②⑤ C. ②④⑤ D. ①②④
【答案】B
【解析】①NH3极易溶于水,烧瓶内压强减小为零,同外界大气压产生压强差,所以形成喷泉,并充满烧瓶; ②CO2与饱和NaOH溶液完全反应,压强近乎没有,同外界大气压产生压强差,能形成喷泉, 最终几乎充满整个烧瓶;③.氯气在饱和食盐水中的溶解度很小,锥形瓶与烧瓶内近乎压强相等,不能形成喷泉;④NO2与水反应,生成硝酸和NO,容器内气体减少,气压减小,形成喷泉,但因为NO不溶于水,所以不会充满烧瓶,⑤HCl极易溶于水并且和0.1 mol·L-1AgNO3溶液反应,使烧瓶内压强减小为零同外界大气压产生压强差,所以形成喷泉,并充满烧瓶;综上所述符合条件的为. ①②⑤。所以B选项是正确的。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】已知下列元素的原子半径,根据表中数据推测磷原子的半径可能是
原子 | N | S | O | Si |
半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80×10-10mB.1.10×10-10mC.1.20×10-10mD.0.70×10-10m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时将a mol/L 氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A. a<1.0 B. 水的电离程度:b<d<c
C. C点:c(NH4+)=1.0mol/L D. d点:c(Cl-)<c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要________(填仪器名称);
(2)装置C的作用是_____________________________;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为______________________________________。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是___________________;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作③。
①55℃蒸发结晶; ②趁热过滤; ③___________;④低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是______;
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是_________________;
②所称取的样品中NaClO2的物质的量为_______________(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲是某学生验证铜和浓硝酸反应的装置,乙、丙是另外两位同学对甲装置改进后的装置:
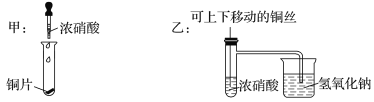
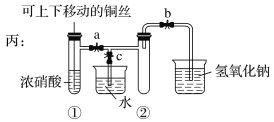
(1)甲、乙、丙三个装置中共同发生的反应的化学方程式是__________________________________。
(2)和甲装置相比,乙装置的优点是①______________________;②________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭活塞________,再打开活塞________,才能使NO2气体充满②试管;当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进入②试管,应该_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一。请回答下列问题:
二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃。
(1)基态Fe2+离子的价电子排布式为_______________________________
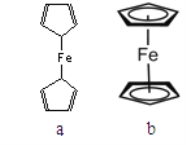
(2)二茂铁属于___________________晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为下图中的________________(选填“a”或“b”)
(3)环戊二烯(![]() )中C的杂化方式 _______________。1mol环戊二烯中含有σ键的数目为___________。
)中C的杂化方式 _______________。1mol环戊二烯中含有σ键的数目为___________。
(4)分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),在C5H5—中的每个碳原子上都有一个未参与σ键的电子,这些电子占据与环的平面垂直的p轨道上。C5H5—的大π键可以表示为______________。
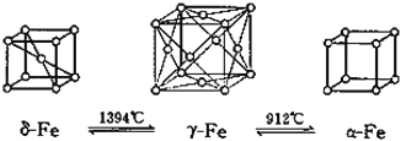
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是_______
A.γ﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ﹣Fe晶胞边长为acm,α﹣Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体性质会产生重大影响。由于晶体缺陷,晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm-3,晶胞边长为4.28×10-10 m,则FexO中x=_____(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸的原料。氨经一系列反应可以得到硝酸,如图所示:
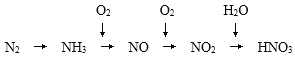
根据已知信息及所学知识回答下列问题:
(1)写出实验室制取氨气的化学方程式_____________;
(2)写出氨的催化氧化的化学方程式_____________;
(3)计算生成1.0mol HNO3需要_______molNH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.铁和稀盐酸反应:2Fe+6H+=2Fe3++H2↑
B.Cu(OH)2和硫酸溶液反应:OH-+H+=H2O
C.Ba(OH)2溶液与盐酸反应:OH-+H+=H2O
D.CaCO3与盐酸反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com