
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
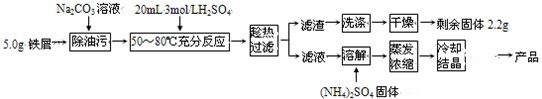 (2009?广州模拟)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下:
(2009?广州模拟)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下: HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 物理性质 | 乙酸 | 乙醇 | 1-丁醇 | 乙酸乙酯 | 乙酸丁酯 |
| 熔点(℃) | 16.6 | -117.3 | -89.5 | -83.6 | -73.5 |
| 沸点(℃) | 117.9 | 78.5 | 117 | 77.06 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.79 | 0.81 | 0.90 | 0.88 |

查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
①实验中观察到的现象是_______________________。
②产生上述现象的原因是_______________________。
③写出有关反应的离子方程式____________。
④由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。

(2)城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭与水蒸气在高温下反应制得,故又称水煤气。试解答:
①写出制取水煤气的主要化学方程式____________。该反应是____________反应(填吸热、放热)。
②设液化石油气的主要成分为丙烷(C3H8),其充分燃烧后产物为CO2和H2O。试比较完全燃烧等质量的C3H8及CO所需的氧气的体积比(同温、同压下)为:____________。
③氢气是未来的能源,燃烧时除产生热量外,还具有的优点是____________。
④使用管道煤气必须防止因煤气泄漏而引起的中毒和爆炸。某住房因煤气泄漏而发生爆炸事故。
调查发现煤气是在达到室内空气质量的6%时发生爆炸的,该住户煤气泄漏速度为0.6g/min,问爆炸时煤气已泄漏约________小时(假设厨房体积为25m3,空气密度约为1.29g/L)。
查看答案和解析>>
科目:高中化学 来源: 题型:022
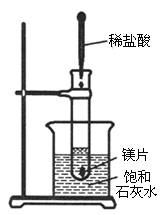
(1)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
①实验中观察到的现象是_______________________。
②产生上述现象的原因是_______________________。
③写出有关反应的离子方程式____________。
④由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
(2)城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭与水蒸气在高温下反应制得,故又称水煤气。试解答:
①写出制取水煤气的主要化学方程式____________。该反应是____________反应(填吸热、放热)。
②设液化石油气的主要成分为丙烷(C3H8),其充分燃烧后产物为CO2和H2O。试比较完全燃烧等质量的C3H8及CO所需的氧气的体积比(同温、同压下)为:____________。
③氢气是未来的能源,燃烧时除产生热量外,还具有的优点是____________。
④使用管道煤气必须防止因煤气泄漏而引起的中毒和爆炸。某住房因煤气泄漏而发生爆炸事故。
调查发现煤气是在达到室内空气质量的6%时发生爆炸的,该住户煤气泄漏速度为0.6g/min,问爆炸时煤气已泄漏约________小时(假设厨房体积为25m3,空气密度约为1.29g/L)。
查看答案和解析>>
科目:高中化学 来源:2014届福建省福州八县市高三上学期期中联考化学试卷(解析版) 题型:填空题
利用废的生铁丝(表面有铁锈)、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下图:
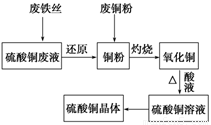
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,其目的是__________________,可能发生反应的离子方程式有Fe+2H+=Fe2++H2↑、_____________________、__________________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO未被还原。还原剂是_______________。
(3)为了使灼烧后的混合物充分酸溶,在加入稀H2SO4的同时,也加入适量的H2O2溶液,并控温在50~60℃,持续反应1h。请回答下列问题:
①反应时温度必须控制在50~60℃,温度不宜过高,这样操作的目的_____;
②写出反应的化学方程式:_____________、________________________________。
(4)由硫酸铜溶液得到硫酸铜晶体的实验操作为________________________。
(5)直接向灼烧后的混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com