
 、
、 混合溶液中,各种离子浓度关系正确的是 ( )
混合溶液中,各种离子浓度关系正确的是 ( )
A. |
B. |
C. |
D. |
科目:高中化学 来源:不详 题型:单选题
| A.醋酸钠溶液显碱性 |
B.10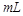  =2的醋酸溶液加水稀释到100 =2的醋酸溶液加水稀释到100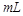   3 3 |
C.中和10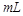 0.1 0.1 醋酸溶液,需要消耗0.1 醋酸溶液,需要消耗0.1 氢氧化钠溶液10 氢氧化钠溶液10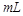 |
| D.0.1 mol·L-1的醋酸溶液中,氢离子浓度约为0.001 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用HNO2溶液做导电实验,灯泡很暗; | B.0.1 mol/L HNO2溶液的pH=2.1 |
| C.HNO2不是离子化物,而是共价化合物 | D.HNO2和NaCl不能发生反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
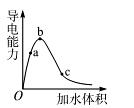
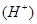 由小到大的顺序是 。
由小到大的顺序是 。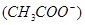 增大,c
增大,c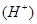 减少,可采取的措施是(至少写出三种方法)
减少,可采取的措施是(至少写出三种方法) 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Al2(SO4)3 ="=" 2Al+3 + 3SO4-2 | B.Na2CO3==Na2+ + CO32- |
| C.NaOH ="=" Na+ + OH- | D.NaHCO3 ==Na+ + H+ + CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
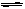 NH4++OH-,当增大溶液的pH时,c(NH4+)会( )
NH4++OH-,当增大溶液的pH时,c(NH4+)会( )| A.可能增大也可能减小 | B.增大 |
| C.减小 | D.无变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com