
| 投料比 CO的体积分数% 温度/℃ | $\frac{n({H}_{2}O)}{n(CO)}$=1 | $\frac{n({H}_{2}O)}{n(CO)}$=3 | $\frac{n({H}_{2}O)}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
分析 (1)根据平衡常数的概念及该反应方程式解答;该反应为放热反应,升高温度,平衡向着逆向移动,则平衡常数减小;
(2)可逆反应达到平衡状态时正逆反应速率相等,各组分的浓度不再变化,据此进行判断;
(3)根据反应速率v=$\frac{△c}{△t}$计算出二氧化碳的反应速率;根据三段式计算出达到平衡时各组分的浓度,根据根据K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$计算出平衡常数;
(4)①根据表中数据判断温度、反应物投料比对CO的体积分数的影响解答;
②根据温度对化学平衡、化学反应速率的影响方面分析.
解答 解:(1)反应CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数表达式为:K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$;
由于该反应为放热反应,温度越高,化学平衡向着逆向移动,则平衡常数越小,所以K(200℃)>K(300℃)(
故答案为:$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$;>;
(2)a.ν消耗(CO)=ν生成(H2O),表示的是正反应速率和逆反应速率,且满足化学计量数关系,说明正逆反应速率相等,达到了平衡状态,故a正确;
b.c(CO2)=c(CO),无法判断正逆反应速率是否相等,无法判断是否达到平衡状态,故b错误;
c.混合气体的总物质的量不再改变:该反应是气体体积不变的反应,无论是否达到平衡状态,气体的总物质的量始终不变,无法根据混合气体的总物质的量判断平衡状态,故c错误;
d.混合气体的密度不再改变:反应气体都是气体,气体的质量不变,容器的容积不变,根据ρ=$\frac{m}{V}$可知,反应过程中气体的密度始终不变,无法根据密度判断平衡状态,故d错误;
故答案为:a;
(3)利用三段式法可得:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:1mol 4mol 0 0
转化:0.8mol 0.8mol 0.8mol 0.8mol
平衡 0.2mol 3.2mol 0.8mol 0.8mol
该时间范围内反应的平均速率ν (CO )=$\frac{\frac{0.8mol}{10L}}{20min}$=0.004 mol•L-1•min-1;
该温度下该反应的平衡常数为:K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{\frac{0.2}{10}×\frac{3.2}{10}}{\frac{0.8}{10}×\frac{0.8}{10}}$=1,
故答案为:0.004 mol•L-1•min-1;1;
(4)①根据表中数据可知,反应物投料比相同时,升高温度,一氧化碳的体积分数增大;温度相同时,配料比越大,一氧化碳的体积分数减小,所以增大CO,增大反应物投料比(或原料气中水蒸气的比例),可以增大CO的转化率,
故答案为:降低温度;增大反应物投料比(或原料气中水蒸气的比例);
②尽管提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面,选择最佳温度为300℃,
故答案为:提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面.
点评 本题考查了化学平衡、化学平衡常数的计算、影响化学反应速率、化学平衡的因素等知识,题目难度较大,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 干冰、铝粉、漂白粉 | B. | 生石灰、臭氧、熟石灰 | ||
| C. | 烧碱、液态氧、酒精 | D. | 铁红、晶体硅、胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
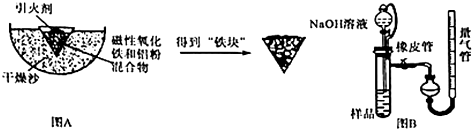
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L甲烷中含氢原子数为0.4NA | |
| B. | 0.3molNO2与足量的水反应转移电子数为0.2NA | |
| C. | 1L0.1mol•L-1Na2CO3溶液中含CO32-数目为0.1NA | |
| D. | 5.6g铁完全溶于足量稀硝酸,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②③⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2 CH CH2CH2CH3B | B. | (CH3 CH2)2 CHCH3 | ||
| C. | (CH3)2 CH CH (CH3)2 | D. | (CH3)3 C CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
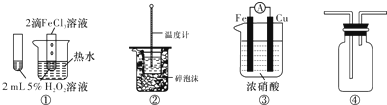
| A. | 图①可验证FeCl3对H2O2分解反应有催化作用 | |
| B. | 图②可用于中和热的测定 | |
| C. | 图③可用于探究铁作负极的原电池原理 | |
| D. | 图④可用于收集NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
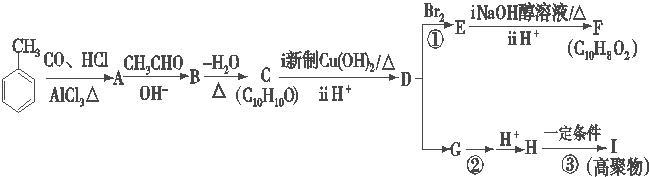
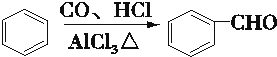
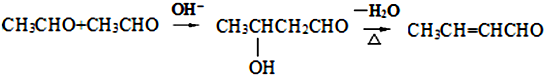
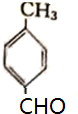 .
.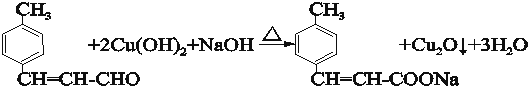 .
.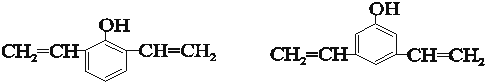 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com