
| A. | 标准状况下,2.24L甲烷中含氢原子数为0.4NA | |
| B. | 0.3molNO2与足量的水反应转移电子数为0.2NA | |
| C. | 1L0.1mol•L-1Na2CO3溶液中含CO32-数目为0.1NA | |
| D. | 5.6g铁完全溶于足量稀硝酸,转移电子数为0.3NA |
分析 A.标况下,2.24L甲烷的物质的量为0.1mol,每个甲烷分子中含有4个H原子;
B.NO2和H2O反应方程式为3NO2+H2O=2HNO3+NO,0.3molNO2与足量的水反应有
0.1molNO2发生还原反应;
C.n(Na2CO3)=0.1mol/L×1L=0.1mol,CO32-为弱酸根离子,能发生两步水解反应,且第一步水解程度远远大于第二步水解程度;
D.该反应方程式为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,根据Fe和转移电子之间的关系式计算.
解答 解:A.标况下,2.24L甲烷的物质的量为0.1mol,每个甲烷分子中含有4个H原子,则标准状况下,2.24L甲烷中含氢原子数=0.1mol×NA/mol×4=0.4NA,故A正确;
B.NO2和H2O反应方程式为3NO2+H2O=2HNO3+NO,0.3molNO2与足量的水反应有
0.1molNO2发生还原反应,则转移电子数=0.1mol×NA/mol×(4-2)=0.2NA,故B正确;
C.n(Na2CO3)=0.1mol/L×1L=0.1mol,CO32-为弱酸根离子,能发生两步水解反应,且第一步水解程度远远大于第二步水解程度,所以1L0.1mol•L-1Na2CO3溶液中含CO32-数目小于0.1NA,故C错误;
D.该反应方程式为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,则转移电子数=0.1mol×NA/mol×(3-0)=0.3NA,故D正确;
故选C.
点评 本题以物质的量为载体考查阿伏伽德罗常数有关计算,为高频考点,明确物质的量公式中各个物理量的关系、物质构成、盐类水解等知识点是解本题关键,侧重考查学生分析计算能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 含Na2CO3的溶液:K+、Cl-、NO3-、Al3+ | |
| B. | pH=11的溶液:Ba2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Cl-、Ba2+ | |
| D. | 滴加甲基橙试液显红色的溶液:Fe3+、NH4+、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe的基态原子外围电子排布图: | |
| B. | 氯化钠的分子式:NaCl | |
| C. | N的基态原子核外电子排布式:lS22S22p3 | |
| D. | HC10的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
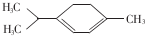 青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 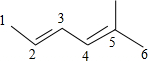 :5-甲基-2,4-己二烯 :5-甲基-2,4-己二烯 | B. |  1,2,3,4-四甲基环己烷 1,2,3,4-四甲基环己烷 | ||
| C. |  :1,3,4-三甲基苯 :1,3,4-三甲基苯 | D. | 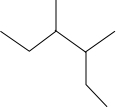 :3-甲基-2-乙基戊烷 :3-甲基-2-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 投料比 CO的体积分数% 温度/℃ | $\frac{n({H}_{2}O)}{n(CO)}$=1 | $\frac{n({H}_{2}O)}{n(CO)}$=3 | $\frac{n({H}_{2}O)}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOCCH(CH3)COONa+2Cu2O↓+6H2O.
+4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOCCH(CH3)COONa+2Cu2O↓+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液盛装在玻璃塞的试剂瓶中 | |
| B. | 新制氯水保存在无色广口瓶中 | |
| C. | 铝片密封保存在细口瓶中 | |
| D. | 金属钠保存在煤油中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com