
【题目】根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W做电极组成的原电池,电极反应为W2++2eˉ = W,Y-2eˉ=Y2+。可知X、Y、W、Z的还原性由强到弱的顺序是
A. X>Z>Y>W B. Z>W>X>Y C. Z>X>Y>W D. Z>Y>X>W
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示。

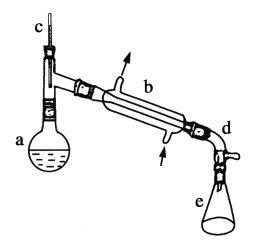
可能用到的相关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是____________。
(2)加入碎瓷片的作用是______________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的________(填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是______________。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶
B.温度计
C.吸滤瓶
D.球形冷凝管
E.接收器
(6)本实验所得到的环己烯产率是________(填正确答案标号)。
A.41% B.50%
C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一。消除氮氧化物有多种方法。
(1)可利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
则CH4(g)将NO2(g)还原为N2(g)的热化学方程式是 。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)ΔH<0。为提高氮氧化物的转化率可采取的措施是(一条即可) 。
2N2(g)+3H2O(g)ΔH<0。为提高氮氧化物的转化率可采取的措施是(一条即可) 。
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。ΔH<0
2CO2(g)+N2(g)。ΔH<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。

(4)利用ClO2氧化氮氧化物反应过程如下:![]()
反应Ⅰ的化学方程式是2NO+ClO2+H2O===NO2+HNO3+2HCl,反应Ⅱ的化学方程式是。若有11.2LN2生成(标准状况),共消耗ClO2 g。
(5)工业废气中含有的NO2还可用电解法消除。用NO2为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4然后采用电解法制备N2O5,装置如下图所示。Pt甲为的电极反应式是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

下列说法中正确的是( )
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )

A.S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.氧化铜与盐酸反应O2―+2H+=H2O
B.二氧化碳通入足量氢氧化钠溶液中:CO2+OH-=HCO3-
C.铝片与硫酸铜溶液反应:2Al+3Cu2+=2Al3++3Cu
D.氢氧化钡溶液与稀H2SO4反应:H++OH-+Ba2++SO42-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列利用相关数据作出的推理或判断一定正确的是
A.利用焓变数据判断反应能否自发进行
B.利用溶液的pH判断该溶液的酸碱性
C.利用平衡常数判断反应进行的程度大小
D.利用反应热数据判断反应速率的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题:
(1)粘土[主要成分Al2Si2O5(OH)4] 是制备陶瓷的原料,请以氧化物形式表示粘土的组成_____________。
(2)现用四氯化硅和氮气在氢气中加强热发生反应,可制得高纯度氮化硅,反应的化学方程式为_________________________。
(3)雕花玻璃是用氢氟酸对玻璃进行刻蚀,这一过程中发生反应的化学方程式为_______。
(4)明矾可用于净水,请说明原因________________________。
(5)下图,若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在, B是白色胶状沉淀。

①实验室中常用A与某种溶液反应制备B,请写出该反应的离子方程式 _________________。
②A与C也可以反应生成B,请写出反应的离子方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com