
| 物 质 | 需加入的试剂 | 有关离子方程式 |
| HNO3(H2SO4) | ||
| Cu(Fe) | ||
| ZnSO4(CuSO4) | ||
| NaCl(Na2CO3) | ||
| FeCl2(FeCl3) |
| 物 质 | 需加入的试剂 | 有关离子方程式 |
| HNO3(H2SO4) | Ba(NO3)2 | Ba2++SO42-=BaSO4↓ |
| Cu(Fe) | HCl | Fe+2H+=Fe2++H2↑ |
| ZnSO4(CuSO4) | Zn | Zn+Cu2+=Zn2++Cu |
| NaCl(Na2CO3) | HCl | 2H++CO32-=CO2↑+H2O |
| FeCl2(FeCl3) | Fe | 2Fe3++Fe=3Fe2+ |


科目:高中化学 来源: 题型:
| A、晶体硅是“信息革命“的支柱材料,可用作光导纤维 |
| B、将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| C、化学反应伴随着能量的变化,反应物总能量一定大于生成物总能量 |
| D、用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
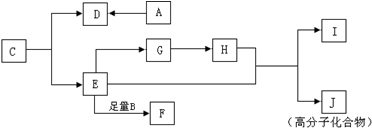
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑥ | B、②④⑤⑥ |
| C、①②④⑤ | D、①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HX是强酸 |
| B、将两种一元酸均稀释100倍,稀释后两溶液的pH均为3 |
| C、酸性:HX<HY |
| D、两酸的浓度大小c(HX)<c(HY) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu、Fe3+ |
| B、Fe2+、Fe3+ |
| C、Cu、Cu2+、Fe |
| D、Cu、Fe2+、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com