
【题目】按照无机物的分类方法,下列各组物质中,属于不同类型的物质是
A.纯碱、烧碱、生石灰 B.生石灰、冰、干冰
C.熟石灰、苛性钠、氢氧化钾 D.纯碱、硫酸钠、胆矾
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 三种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出对应的元素符号:C________,D_______
(2)用电子式表示A与E两元素形成化合物的过程:___________________________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在一个2L的密闭容器中,发生反应2SO3(g)![]() 2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
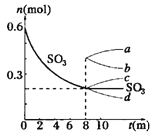
(1)用O2表示0~8min内该反应的平均速率v=__________.
(2)升高温度, K值将__________;容器中气体的平均相对分子质量将__________.(填“增大”“减小”或“不变”)
(3)能说明该反应已达到平衡状态的是__________
a.v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(4)从8min起,压缩容器为1L,则SO3的变化曲线为__________
A. a B. b C. c D. d.
II、将气体A、B置于容积为2L的密闭容器,发生如下反应:4A(g)+B(g)=2C(g)起始时充入0.5molB和一定量的A,反应进行到4s末,测得v(B)=0.0125mol·L-1·s-1,A、C均为0.2mol。则
(1)V(A) =____________
(2)反应前A有_________mol
(3)B的转化率为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的化工原料,工业上将NO2在密闭容器中经多次氧化,用水反复循环吸收制备硝酸。
(1)假定上述过程无其他损失,试写出上述反应的化学方程式:______________________;
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置己略去)。

①检査装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入__________至U形管右侧胶塞下沿后,迅速关闭K1,U形管内反应的化学方程式是_________________。
②蘸NaOH溶液的棉花团的作用是____________;
③装置Ⅲ的作用为_________________________;
④打开K2,长玻璃管中液面上升,____________则证明NO也可以与氧气和水共同反应生成HNO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用碱式滴定管量取25 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
回答下列问题:
(1)正确的操作步骤顺序中B前面是________、D后面是________(用字母填写)。
(2)滴定读数应注意:滴定管与水平的实验台面______________,并使刻度线与滴定管液面的____________相切。
(3)操作D中液面应调整到________________的某一刻度。
(4)滴定到终点时锥形瓶内溶液的pH约为_______________;终点时的颜色变化是________________。
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响_______________
(6)该烧碱样品的纯度计算式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
⑴写出基态Zn原子的价电子排布式__________,基态S原子核外未成对电子数为_____。
⑵ZnSO4中三种元素的电负性由大到小的顺序为_____________________,SO42-的立体构型为________________,其中S的杂化轨道类型为_________。
⑶硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有___________。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
⑷根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为___________;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因________________。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
⑸立方ZnS晶体的密度为ρg·cm-3,其晶胞结构如图。S2-周围等距离且最近的Zn2+、S2-依次为______、______;ZnS晶胞中的晶胞参数a=________nm(列出计算式)。
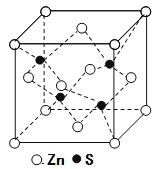
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意回答问题:
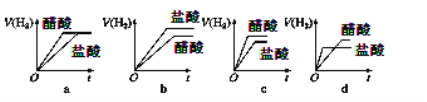
(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加水稀释10倍后,醋酸溶液中的c(H+) 盐酸溶液中的c(H+)(填“>”、“=”或“<”)。
②加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积:醋酸 盐酸(填“>”、“=”或“<”)。
③使温度都升高20℃,溶液中c(H+):醋酸 盐酸(填“>”、“=”或“<”)。
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是 (填字母)。
(2)下图是电解质溶液中加入新物质时溶液的导电性能发生变化性情况(电流强度(I)随新物质加入量(m)的变化曲线),将对应的图像字母填写在下列横线上。
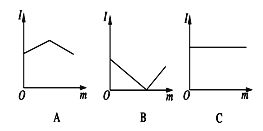
①氢氧化钡溶液中滴入硫酸溶液至过量 。
②醋酸溶液中滴入氨水至过量 。
③澄清石灰水中通入CO2至过量 。
(3)已知下表中的电离平衡常数,回答问题

① HSO![]() 的电离平衡常数表达式为: 。
的电离平衡常数表达式为: 。
② H2SO3溶液与NaHCO3溶液反应的主要离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com