
【题目】根据题意回答问题:
(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加水稀释10倍后,醋酸溶液中的c(H+) 盐酸溶液中的c(H+)(填“>”、“=”或“<”)。
②加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积:醋酸 盐酸(填“>”、“=”或“<”)。
③使温度都升高20℃,溶液中c(H+):醋酸 盐酸(填“>”、“=”或“<”)。
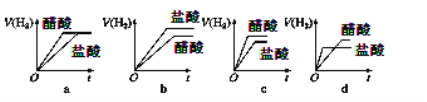
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是 (填字母)。
(2)下图是电解质溶液中加入新物质时溶液的导电性能发生变化性情况(电流强度(I)随新物质加入量(m)的变化曲线),将对应的图像字母填写在下列横线上。
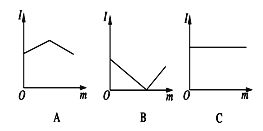
①氢氧化钡溶液中滴入硫酸溶液至过量 。
②醋酸溶液中滴入氨水至过量 。
③澄清石灰水中通入CO2至过量 。
(3)已知下表中的电离平衡常数,回答问题

① HSO![]() 的电离平衡常数表达式为: 。
的电离平衡常数表达式为: 。
② H2SO3溶液与NaHCO3溶液反应的主要离子方程式为 。
【答案】
(1)①>(1分)②>(1分)③>(1分)④c(1分)
(2)①B(1分)②A(1分)③B(1分)
(3)①Ka=![]() (1分)
(1分)
②H2SO3+HCO![]() =H2O+CO2↑+HSO
=H2O+CO2↑+HSO![]() (2分)
(2分)
【解析】
试题分析:
(1)①pH相同、体积相同的醋酸和盐酸两种溶液,加水稀释10倍后,若平衡不移动,则醋酸溶液中的c(H+)等于盐酸溶液中的c(H+),但加水稀释促进醋酸电离,则醋酸溶液中的c(H+)大于盐酸溶液中的c(H+);
②pH相同、体积相同的醋酸和盐酸两种溶液,醋酸溶液的物质的量大于盐酸,加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积,醋酸大于盐酸;
③升高温度促进醋酸电离,c(H+)增大,氯化氢完全电离,所以不受温度影响,则醋酸中c(H+)大于盐酸;
④与足量的锌反应时,生成氢气的量与酸的物质的量成正比,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,所以pH、体积相等的醋酸和盐酸,醋酸的物质的量大于盐酸,则分别与足量的锌反应醋酸放出的氢气多,且醋酸产生氢气的速率更快,故c正确。
(2)①氢氧化钡溶液中滴入硫酸溶液至过量,发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,滴入H2SO4时,导电性减弱,完全反应后,H2SO4过量,导电性又增强,与B一致。
②醋酸溶液中滴入氨水至过量,发生反应CH3COOH+NH3·H2O=CH3COONH4+H2O,导电性增强,但氨水过量后,将溶液稀释,导电性减弱,与A一致。
③澄清石灰水中通入CO2至过量,发生反应Ca(OH)2+CO2=CaCO3↓+H2O,导电性减弱,CO2过量后,CaCO3+CO2+H2O=Ca(HCO3)2,Ca(HCO3)2电离使导电性又增强,与B一致。
(3) ①H2SO3为二元弱酸,发生分步电离,第二步电离方程式为HSO![]()
![]() H++SO
H++SO![]() ,则 HSO
,则 HSO![]() 的电离平衡常数表达式为:Ka=
的电离平衡常数表达式为:Ka=![]() 。
。
② 根据电离常数关系可知,电离常数越大,酸性越强,则有H2SO3>H2CO3>HSO![]() >HCO
>HCO![]() 。则H2SO3溶液与NaHCO3溶液反应的主要离子方程式为H2SO3+HCO
。则H2SO3溶液与NaHCO3溶液反应的主要离子方程式为H2SO3+HCO![]() =H2O+CO2↑+HSO
=H2O+CO2↑+HSO![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】按照无机物的分类方法,下列各组物质中,属于不同类型的物质是
A.纯碱、烧碱、生石灰 B.生石灰、冰、干冰
C.熟石灰、苛性钠、氢氧化钾 D.纯碱、硫酸钠、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子aA2+、bB+、cC3﹣、dD﹣都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径 A>B>D>C B. 原子序数 d>c>b>a
C. 离子半径 C>D>B>A D. 单质的还原性 A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g) = H2(g)+I2(g).若c(HI)由0.1 mol·L-1降到0.07 mol·L-1需要15 s,那么c(HI)由0.07 mol·L-1时降到0.05 mol·L-1时,所需反应的时间为( )
A. 等于5 s B. 等于10 s C. 大于10 s D. 小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
物质 | A | B | C |
初始浓度/mol·L-1 | 1.0 | 2.0 | 0 |
2min时,平衡浓度/mol·L-1 | 0.4 | 0.2 | 1.2 |
请填写下列空白:
(1)该反应方程式可表示为: ;反应达平衡时,A的转化率为___________。
(2)从反应开始到达化学平衡,生成C的平均反应速率为 ;25℃时,反应的化学平衡常数K值(数值)为_____________。
(3)能判断该反应已达到化学平衡状态的依据是__________。
a.容器内压强不变
b.混合气体的密度不变
c.3v正(B)=2v逆(C)
d.c(A)=c(C)
e.混合气体的平均相对分子质量不变
(4)若已知该反应为放热反应,下图表示由于条件改变而引起反应速度和化学平衡的变化情况:
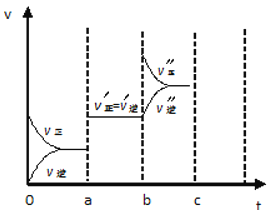
a 点时改变的条件可能是 ;b点时改变的条件可能是 。
(5)如果上述反应起始是按“1 mol A+3 mol B”充入,达平衡时C的浓度为a mol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为a mol/L的是 (填序号)
①2 mol A+6 mol B ②2mol C ③4mol C ④0.5 mol A+1.5mol B+1 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知某可逆反应mA(g)+nB(g)=qC(g) ΔH,在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气倦中的体积分数ψ(B)的变化情况。下列推断中正确的是

A. p1<p2,T1>T2,m+n<q,ΔH>0
B. p1>p2,T1<T2,m+n>q,ΔH<0
C. p1<p2,T1>T2,m+n>q,ΔH>0
D. p1>p2,T1<T2,m+n<q,ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com