
下列有关化学与生活、生产的叙述错误的是
A.用作“钡餐”的物质主要成分是硫酸钡
B.采用催化设施,将汽车尾气中CO和NO转化为无害气体
C.SO2具有还原性,可用于漂白纸浆
D.常温下,可以用铁制容器来盛装冷的浓硫酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年北京大学附属中学分校高二上抽考化学试卷(解析版) 题型:选择题
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)  NH3 (g)+HI(g);②2HI(g)
NH3 (g)+HI(g);②2HI(g)  H2(g)+I2(g)。达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为
H2(g)+I2(g)。达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为
A.9 B.16 C.20 D.25
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高一上10月月考化学试卷(解析版) 题型:选择题
1g N2中含有n个N2的分子,则阿伏加德罗常数(NA)可以表示为
A.14n mol-1 B.28n mol-1 C.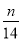 mol-1 D.
mol-1 D.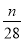 mol-1
mol-1
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期四调考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.电解精炼铜时,若阳极质量减少64g,则转移到阴极的电子不一定等于2NA
B.1molNa2O2晶体中共含有4NA个离子
C.1.0L1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA
D.常温下pH=1的H2SO4溶液中,H+的浓度为0.2mol/L
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验操作 | 现象 | 结论 |
A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 铝不能熔化 | 金属铝的熔点较高 |
D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:填空题
(10分)某待测液中可能含有大量Mg2+、Cu2+、Fe3+、K+、H+、NO3-、SO42-、OH-离子中的一种或几种,现通过下实验进行检验:
(1)取少量待测液,仔细观察,呈无色;
(2)向上述待测液中滴加NaOH溶液,先无明显现象,后有白色沉淀生成,
(3)像上述溶液中加入BaCl2溶液,无现象。
据此可以判断该待测液中一定大量存在的离子是 ,一定不能大量存在的离子是 ,不能确定是否存在的离子是 ,依次写出(2)中加入氢氧化钠后的离子反应: , 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:选择题
下列各物质的分类、名称(或俗名)、化学式都正确的是
A.金属氧化物 氧化铁 FeO
B.非金属氧化物 二氧化硫 SO2
C.含氧酸 硫酸 H2SO3
D.碱 纯碱 Na2CO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上第一阶段测化学试卷(解析版) 题型:填空题
(10分)自2013年3月我国北方地区出现了雾霾天气,其产生的原因说法不一,汽车的尾气排放被称为原因之一,有关氮的化合物的研究是一项重要课题。
(1).已知N2(g)+O2(g)=2NO(g) ΔH=+180.5KJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH= -566.0 KJ·mol-1
则加催化剂处理汽车尾气的热化学方程是
(2).反应2NO2(g) 2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
时间(s) | 0 | 10 | 20 | 25 | 30 |
条件A [n(NO2)](mol) | 0.20 | 0.14 | 0.13 | 0.13 | 0.13 |
条件B [n(NO2)](mol) | 0.20 | 0.10 | 0.10 | 0.10 | 0.10 |
①条件A与条件B表示的是该反应在某不同条件的反应状况,该不同条件是
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO) B.c(NO2)=c(NO) C.O2的物质的量不变
D.混合气体的密度不变 E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为 mol·L-1·s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应 (填“正向”、“逆向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷(解析版) 题型:填空题
(10分)FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:_____ClO3-+______Fe2++______ =_____Cl-+_____Fe3++______
(3)FeCl3 在溶液中分三步水解:Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2 Fe(OH)++H2O
Fe(OH)2++H+ K2 Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com