
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
(2)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) 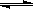 CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。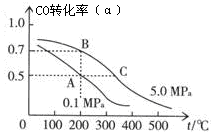
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K= ;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总= 。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 。
A.降温 B.加压 C.使用催化剂 D.将甲醇从混合体系中分离出来
(1)-524.83kJ?mol-1 3mol(2)①VA2/100 5:4 ②大于 ③ABD
解析试题分析:(1)根据①C(s)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1;②2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ?mol-1;③C(s)+H2O(g)═CO(g)+H2(g)△H3=+131.3kJ?mol-1三个热化学方程式,利用盖斯定律,将①-③可得反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g);△H=-393.5kJ?mol-1-131.3kJ?mol-1=-524.83kJ?mol-1;CO、H2与氧气反应的方程式分别为:2CO+O2 2CO2;2H2+O2
2CO2;2H2+O2 2H2O,从方程式可以看出相同物质的量的CO、H2燃烧转移的电子数目相等,所以标准状况下CO、H233.6L与氧气反应生成CO2和H2O转移的电子的物质的量为:﹛(33.6L)/(22.4L/mol)﹜×2=3mol。(2)①根据图象可以看出,A点时CO的转化率为50%,则平衡时各物质的量浓度为:c(CO)=(5mol/L)/VA;c(H2)=(10mol/L)/VA;c(CH3OH)=(5mol/L)/VA;所以平衡常数为=c(CH3OH)/c(CO)×c2(H2)=[(5mol/L)/VA]/[(5mol/L)/VA]·[(10mol/L)/VA]2=VA2/100;根据图象可以看出,A点时CO的转化率为50%,故平衡时CO、H2、CH3OH的物质的量分别为5mol、10mol、5mol,根据图象可以看出,A点时CO的转化率为70%,故平衡时CO、H2、CH3OH的物质的量分别为3mol、6mol、7mol,A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总=20:16=5:4 ②升高温度,反应速率增大,反应开始到达平衡状态所需的时间要少,所以反应开始到达平衡状态所需的时间tA 大于tC;③提高转化率应使平衡向正反应方向移动,根据反应方程式的特征可明显判断出可采取的措施为:降温、加压,将甲醇从混合体系中分离出来,故答案为:降温、加压,将甲醇从混合体系中分离出来。
2H2O,从方程式可以看出相同物质的量的CO、H2燃烧转移的电子数目相等,所以标准状况下CO、H233.6L与氧气反应生成CO2和H2O转移的电子的物质的量为:﹛(33.6L)/(22.4L/mol)﹜×2=3mol。(2)①根据图象可以看出,A点时CO的转化率为50%,则平衡时各物质的量浓度为:c(CO)=(5mol/L)/VA;c(H2)=(10mol/L)/VA;c(CH3OH)=(5mol/L)/VA;所以平衡常数为=c(CH3OH)/c(CO)×c2(H2)=[(5mol/L)/VA]/[(5mol/L)/VA]·[(10mol/L)/VA]2=VA2/100;根据图象可以看出,A点时CO的转化率为50%,故平衡时CO、H2、CH3OH的物质的量分别为5mol、10mol、5mol,根据图象可以看出,A点时CO的转化率为70%,故平衡时CO、H2、CH3OH的物质的量分别为3mol、6mol、7mol,A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总=20:16=5:4 ②升高温度,反应速率增大,反应开始到达平衡状态所需的时间要少,所以反应开始到达平衡状态所需的时间tA 大于tC;③提高转化率应使平衡向正反应方向移动,根据反应方程式的特征可明显判断出可采取的措施为:降温、加压,将甲醇从混合体系中分离出来,故答案为:降温、加压,将甲醇从混合体系中分离出来。
考点:氧化还原反应的电子转移数目计算;用盖斯定律进行有关反应热的计算;化学平衡。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
(15分)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g) + CO2(g) +2H2O(g) ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g)=2N2(g) + CO2(g) + 2H2O(g) ⊿H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 。
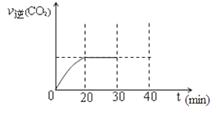
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
| NO | N2 | CO2 | ||
| 0 | 1.00 | 0 | 0 | ||
| 10 | 0.58 | 0.21 | 0.21 | ||
| 20 | 0.40 | 0.30 | 0.30 | ||
| 30 | 0.40 | 0.30 | 0.30 | ||
| 40 | 0.32 | 0.34 | 0.17 | ||
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。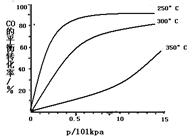
(1)NO2可用水吸收,相应的化学反应方程式为 。
利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol
2NO2(g) ΔH="-113.0" kJ·mol
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
该温度下,此反应的平衡常数表达式K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
请回答下列问题:
(1)图中A、C分别表示__________、______________,E的大小对该反应的反应热有无影响?______________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________;
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=________mol/(L·min)
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=_ _。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)家用液化石油气的主要成分之一是丁烷(C4H10),当10 kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×105 kJ。试写出丁烷燃烧的热化学方程式: 。已知1mol液态水汽化时需要吸收44 kJ热量,则反应C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(g)的ΔH= 。
(2)有同学用丁烷与空气为原料制作一燃烧电池,通入丁烷的一极为 极。若以稀硫酸为电解质溶液时,其正极反应式为 。
(3)已知:Fe(s) +1/2O2(g)=FeO(s) ΔH=-272.0kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) ΔH=-1675.7kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是 。
(4)已知拆开1 mol H-H键,1 molN-H键,1 molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.甲醇是一种新型的能源。
(1)合成气(组成为H2和CO)是生产甲醇的重要原料,请写出由焦炭和水在高温下制取合成气的化学方程式 。
(2)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为l L的密闭容器中,由CO和H2合成甲醇。在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是 (填序号)
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=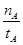 (mol·L-1·min-1) (mol·L-1·min-1) |
| B.该反应在T1时的平衡常数比T2时的大 |
| C.该反应为吸热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时 减小 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,通常主要表现为热量的变化。
①下列反应中,属于放热反应的是___________(填序号)。
a. Ba(OH)2·8H2O与NH4Cl混合搅拌
b. 高温煅烧石灰石
c. 铝与盐酸反应
②某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是_______(填“吸热”或“放热”)反应,其离子方程式是_______________。
(2)电能是现代社会应用最广泛的能源之一。
下图所示的原电池装置中,其负极是_____________________,正极上能够观察到的现象是____________________________,正极的电极反应式是_________________________。
原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CO2的固定和利用在降低温室气体排放中具有重要作用,从CO2加氢合成甲醇不仅可以有效缓解减排压力,还是其综合利用的一条新途径。CO2和H2在催化剂作用下能发生反应CO2+3H2 CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
(1)提高甲醇产率的措施是 。
(2)分析图中数据可知,在220 ℃、5MPa时,CO2的转化率为 ,再将温度降低至
140℃,压强减小至2MPa,化学反应速率将 (填“增大、减小 或 不变“ 下同),CO2的转化率将 。
(3)200℃时,将0.100molCO2和0.275molH2充入1L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,则此温度下该反应的平衡常数K= 。(要求写出算式和计算结果)
(4)已知已知:CO的燃烧热△H=-283.0KJ/mol、2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol、
CO(g)+2H2(g)=CH3OH(g) △H=-90.1KJ/mol,写出CO2与H2合成甲醇的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示:
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示: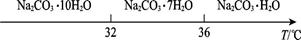
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(0H)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
 Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g) ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1 Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g)  ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com