
(15分)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g) + CO2(g) +2H2O(g) ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g)=2N2(g) + CO2(g) + 2H2O(g) ⊿H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
| NO | N2 | CO2 | ||
| 0 | 1.00 | 0 | 0 | ||
| 10 | 0.58 | 0.21 | 0.21 | ||
| 20 | 0.40 | 0.30 | 0.30 | ||
| 30 | 0.40 | 0.30 | 0.30 | ||
| 40 | 0.32 | 0.34 | 0.17 | ||
| 50 | 0.32 | 0.34 | 0.17 |
(1) CH4(g)+2NO2(g)=N2(g) + CO2(g) +2H2O(l);⊿H= -955 kJ·mol-1(2分)
(2) 2Fe3+ + SO2+ 2H2O=2Fe2++SO42-+4H+ (2分) (3) ① 0.009 mol·L-1·min-1(2分)
②K=0.56(2分) ③不变(2分) ④C、D (2分) ⑤减小 CO2的浓度 (1分)
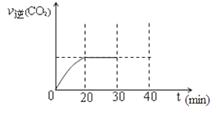
作图要点:(2分)①起点在30min时V逆(CO 2)的一半左右 ②终点不超过30min时V逆(CO 2)
解析试题分析:(1)根据热化学方程式①CH4(g)+4NO2(g)=4NO(g) + CO2(g) +2H2O(g) ⊿H= -574 kJ·mol-1、②CH4(g) +4NO(g)=2N2(g) + CO2(g) + 2H2O(g) ⊿H=-1160 kJ·mol-1、③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1,依据盖斯定律可知(①+②)× +③×2即得到反应CH4(g)+2NO2(g)=N2(g) + CO2(g) +2H2O(l),则该反应的反应热△H=(-574 kJ·mol-1-1160 kJ·mol-1)×
+③×2即得到反应CH4(g)+2NO2(g)=N2(g) + CO2(g) +2H2O(l),则该反应的反应热△H=(-574 kJ·mol-1-1160 kJ·mol-1)× -44.0 kJ·mol-1×2=-955 kJ·mol-1。
-44.0 kJ·mol-1×2=-955 kJ·mol-1。
(2)根据方程式4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O可知,反应中有铁离子生成。而铁离子具有氧化性,能把SO2氧化生成硫酸,因此另一个反应的离子方程式为2Fe3+ + SO2+ 2H2O=2Fe2++SO42-+4H+。
(3)①根据表中数据可知,10min~20min内CO2的浓度变化量=0.30mol/L-0.21mol/L=0.09mol/L,因此以v(CO2)表示的反应速率v(CO2)= =0.009 mol·L-1·min-1。
=0.009 mol·L-1·min-1。
②根据表中数据可知,反应进行到20min时各物质的浓度不再发生变化,此时反应达到平衡状态,则根据平衡常数表达式K= =
=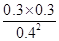 =0.56。
=0.56。
③根据方程式可知,该反应前后体积不变,且反应物只有NO是气体。因此改变NO的起始浓度相当于改变压强,平衡不移动,所以NO的转化率不变。
④在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。A、该反应前后体积不变,因此压强始终是不变的,所以容器内压强保持不变不能作为判断的依据,A不正确;B、根据方程式并依据反应速率之比是相应的化学计量数之比可知2v正(NO)=2×2v正(N2)=v逆(N2),所以氮气的正逆反应速率不相等,B不正确;C、容器内CO2的体积分数不变说明正反应速率相等,达到平衡状态,C正确;D、密度度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但混合气的质量是变化的,因此当混合气体的密度保持不变时说明混合气的质量不再发生变化,可以说明反应达到平衡状态,D正确,答案选CD。
⑤根据表中数据可知,反应从30min~40min时NO的浓度减小,氮气的浓度增大,而CO2的浓度减小,因此改变的条件应该是减小了CO2的浓度;30min后降低了CO2的浓度,平衡向正反应方向移动,但最终平衡时CO的浓度仍然比原平衡时小,所以此时的图像可表示为 。
。
考点:考查热化学方程式的书写、氧化还原反应的应用;反应速率和平衡常数计算、外界条件对平衡状态的影响、平衡状态的判断以及图像作图


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH="a" kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)
FeO(s)+CO(g) ΔH="a" kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g) CO2(g) ΔH="b" kJ·mol-1;反应③Fe2O3(s)+3CO(g)
CO2(g) ΔH="b" kJ·mol-1;反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH="c" kJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH="c" kJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
汽车尾气中NOx的消除及无害化处理引起社会广泛关注。
(1)某兴趣小组查阅文献获得如下信息:
N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(g)) △H=―483.6kJ/mol
则反应2H2(g)+2NO(g)=2H2O(g)+N2(g) △H= 。
(2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。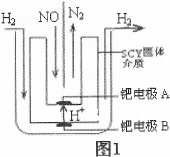
钯电极A为 极,电极反应式为 。
(3)氨法催化还原NO原理如下:
主反应:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) (△H <0)
4N2(g)+6H2O(g) (△H <0)
副反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
4NH3(g)+ 4O2(g) 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g)
4NO(g)+4NH3(g)+3O2(g) 4N2O(g)+6H2O(g)
4N2O(g)+6H2O(g)
有关实验结论如图2、图3所示,据此回答以下问题: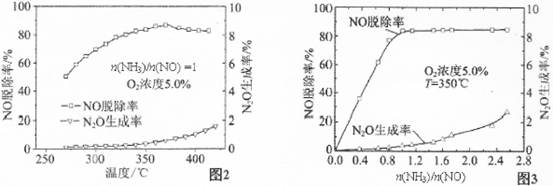
①催化还原NO应控制n(NH3)/n(NO)的最佳值为 ,理由是 。
②主反应平衡常数表达式:K= ,随着温度的增加,K将 (选填“增加”、 “减小”或“不变”。
③影响N2O生成率的因素有 、氧气浓度和 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
(2)已知:N2(g)+ O2(g)=2 NO(g) △H=+180 kJ ? mol-1
2NO(g)+2 CO(g)=N2(g) + 2 CO2(g) △H=-746 kJ ? mol-1
则反应CO(g) + O2(g)=CO2(g)的 △H= kJ ? mol-1。
O2(g)=CO2(g)的 △H= kJ ? mol-1。
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
(4)在固定体积的密闭容器中,1.0×103 kPa时,发生反应 N2(g)+3H2(g) 2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。工业上依此用CO生产燃料甲醇。
CH3OH(g)。工业上依此用CO生产燃料甲醇。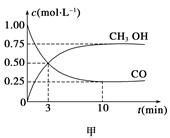
(1)甲图是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(CO)=__________________。
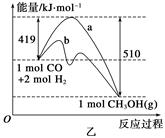
(2)乙图表示该反应进行过程中能量的变化。曲线b下的反应条件为 。该反应的焓变是________(填“ΔH<0”或“ΔH>0”),写出反应的热化学方程式:____________________________________;选择适宜的催化剂__________(填“能”或“不能”)改变该反应的反应热。
(3)该反应平衡常数K的表达式为_____________________________________________,
温度升高,平衡常数K________(填“增大”、“不变”或“减小”)。
(4)恒容条件下,下列措施中能使 增大的有____________。
增大的有____________。
a.降低温度
b.充入He气
c.再充入1 mol CO和2 mol H2
d.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“富煤、贫油、少气”是我国能源发展面临的现状。随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。下图是煤化工产业链之一。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol–1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ·mol–1 ②
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= _________kJ·mol–1。在标准状况下,33.6 L的煤炭合成气(设全部为CO和H2)与氧气完全反应生成CO2和H2O,反应中转移______mole-。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形能说明上述反应已达到平衡状态的是_______
a.体系压强保持不变
b.密闭容器中CO、H2、CH3OH(g)3种气体共存
c.CH3OH与H2物质的量之比为1:2
d.每消耗1 mol CO的同时生成2molH2
②CO的平衡转化率(α)与温度、压强的关系如图所示。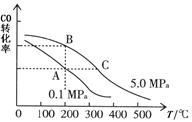
A、B两点的平衡常数_____(填“前者”、“后者”或“一样”)大;达到A、C两点的平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是_____________(答出两点即可)。
(3)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体为正极燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO + H2-4e- + 2CO32-= 3CO2+H2O;则该电池的正极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
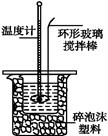
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol—1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol—1
则甲烷直接将NO2还原为N2的热化学方程为 。
(2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= 。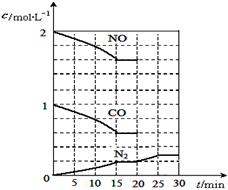
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、 “向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如上图所示的变化,则改变的条件可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)肼(N2H4)用亚硝酸(HNO2)氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
(2)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。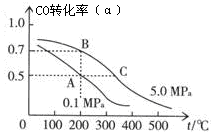
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K= ;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总= 。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 。
A.降温 B.加压 C.使用催化剂 D.将甲醇从混合体系中分离出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com