
����ú��ƶ�͡����������ҹ���Դ��չ���ٵ���״��������Դ��������ţ���չ��ú���������ҹ���Դ�ṹ�ĵ���������Ҫ���塣��ͼ��ú������ҵ��֮һ��
���ྻú�������о����������൱�ձ飬������Աͨ�������ú������¯�н�����������ˮ�����ķ���������������ֵ�ܸߵ�ú̿�ϳ���������Ҫ�ɷ���CO��H2��CO��H2����Ϊ��Դ�ͻ���ԭ�ϣ�Ӧ��ʮ�ֹ㷺��
��1����֪��C(s)+O2(g)=CO2(g) ��H1����393.5 kJ��mol�C1 ��
C(s)+H2O(g)=CO(g)+H2(g) ��H2����131.3 kJ��mol�C1 ��
��ӦCO(g)+H2(g) +O2(g)= H2O(g)+CO2(g)����H= _________kJ��mol�C1���ڱ�״���£�33.6 L��ú̿�ϳ���(��ȫ��ΪCO��H2)��������ȫ��Ӧ����CO2��H2O����Ӧ��ת��______mole����
��2����һ���ݵ��ܱ������У���CO��H2�ϳɼ״���CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
������������˵��������Ӧ�Ѵﵽƽ��״̬����_______
a����ϵѹǿ���ֲ���
b���ܱ�������CO��H2��CH3OH(g)3�����干��
c��CH3OH��H2���ʵ���֮��Ϊ1:2
d��ÿ����1 mol CO��ͬʱ����2molH2
��CO��ƽ��ת����(��)���¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��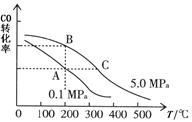
A��B�����ƽ�ⳣ��_____(�ǰ�ߡ��������ߡ���һ����)�ﵽA��C�����ƽ��״̬�����ʱ��tA tC(����ڡ�����С�ڡ����ڡ�)��
�ڲ��ı䷴Ӧ������������£�Ϊ���CO��ת���ʿɲ�ȡ�Ĵ�ʩ��_____________(������㼴��)��
��3�������¶�650���������ȼ�ϵ�أ�����ú̿��(CO��H2)������ȼ����������CO2�Ļ������Ϊ����ȼ������һ��������Li2CO3��Na2CO3���۵�����������ʣ��Խ�����(ȼ�ϼ�)Ϊ�����Ƴɵġ������ĵ缫��ӦʽΪ��CO + H2��4e�� + 2CO32��= 3CO2+H2O����õ�ص�������ӦʽΪ____________��
��1�� ��524.8 (2��) 3 (2��)
��2�� ��a d (2��)
��һ�� (2��) ���� (2��) ���¡���ѹ�����״��ӻ����ϵ�з������ (2��)
��3�� O2 + 4e�C + 2CO2 = 2CO32�C (2��)
���������������1�����ݸ�˹���ɣ��������Ȼ�ѧ����ʽ��������٣��ڵã�CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g)����H=��H1����H2����393.5 kJ��mol�C1��131.3 kJ��mol�C1����524.8kJ��mol�C1��CO��CO2ת��2mole�C��H2��H2Oת��2mole�C����1.5molCO��H2�Ļ��������O2��ȫ��Ӧ����CO2��H2Oʱ��ת��3mol���ӡ���2����a������ӦΪ�����������С�ķ�Ӧ����ѹǿ����ʱ��˵��������Ũ�Ȳ��ٱ仯����Ӧ�ﵽƽ��״̬��b��CO��H2��CH3OH(g)3�����干��ʱ������ȷ��Ũ���Ƿ�ᷢ���仯��������ȷ���Ƿ���һ���ﵽƽ��״̬��c��CH3OH��H2���ʵ���֮��Ϊ1:2������ȷ����Ũ�Ȳ��䣬��ˣ�����ȷ���Ƿ���һ���ﵽƽ��״̬����d��������1 mol CO��ͬʱ����2molH2ʱ��˵�����淴Ӧ������ȣ�����Ӧ�ﵽƽ��״̬����A��B������¶���ͬ������ƽ�ⳣ����ȣ���ͼ����A��C�����ת������ȣ���C����¶ȸߣ���Ӧ���ʴ���ƽ���ʱ��̡���ͼ�����¶Ƚ���CO��ת�������÷�ӦΪ�����������С�ķ�Ӧ����ѹ��ʹƽ��������Ӧ�����ƶ���CO��ת��������c(CH3OH)��С��ƽ��Ҳ��������Ӧ�����ƶ���CO��ת��������3��ȼ�յ�ص�����ΪO2�õ��ӣ����ǵ�����ܷ�ӦΪH2��CO��O2��Ӧ����CO2��H2O����������CO32�C���뷴Ӧ��������Ӧ����CO32�C���ɣ���������ӦʽΪ��O2 + 4e�C + 2CO2 = 2CO32�C��
���㣺���鷴Ӧ�ȵļ��㡢��ѧƽ��״̬���жϡ�ƽ���ƶ�ԭ����Ӧ�ü�ԭ��ص缫��Ӧʽ����д������ѧ���ۺϷ�����������ѧ֪ʶ���������������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ���Ʊ� BaC12 �Ĺ�������ͼ��ͼ��ʾ��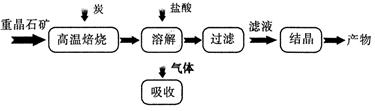
ij�о�С����ʵ�������ؾ�ʯ����Ҫ�ɷ�BaSO4���Թ�ҵ���̽���ģ��ʵ�顣����ã�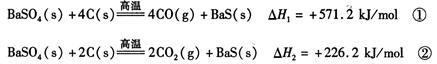
��1����ӦC(s) + CO2(g) 2CO(g)�ġ�H = kJ/mol
2CO(g)�ġ�H = kJ/mol
��2�����˹�������Ҫʹ�ò��������������������� ��
��3�������ܽⱺ�յĹ�������������ù��� NaOH ��Һ���գ��õ�������Һ�� Na2S ˮ������ӷ���ʽΪ ��
��4����BaCl2��Һ�м���AgNO3��KBr,�����ֳ�������ʱ��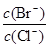 = ��[��֪��
= ��[��֪��
Ksp(AgBr) = 5.4��10��13 , Ksp(AgCl) = 2.0��10��10]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����̲��Ŵ����ġ���ȼ�������ü�����ˮú����CO��H2�����ٺϳɼ״����������湩Ӧ���ŵ�ȼ�͡�
��֪���� CH4(g)��H2O (g)��CO (g)��3H2 (g) ��H1��+206.2kJ��mol-1
�� CH4(g)��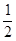 O2(g)��CO(g)��2H2(g) ��H2=��35.4 kJ��mol-1
O2(g)��CO(g)��2H2(g) ��H2=��35.4 kJ��mol-1
�� CH4 (g)��2H2O (g)��CO2 (g)��4H2 (g) ��H3��+165.0 kJ��mol-1
��1��CH4(g)��CO2 (g)��Ӧ����CO(g)��H2(g)���Ȼ�ѧ����ʽΪ ��
��2����ԭ�ϡ���Դ���õĽǶȣ�������Ӧ����Ϊ�ϳɼ״������˷�����ԭ���� ��
��3��ˮú���е�H2����������NH3���ڽ���ϳ���ǰ����[Cu(NH3)2]Ac��Һ���������е�CO����ֹ�ϳ����еĴ����ж����䷴Ӧ�ǣ� [Cu(NH3)2]Ac + CO + NH3  [Cu(NH3)3]Ac��CO ��H��0
[Cu(NH3)3]Ac��CO ��H��0
[Cu(NH3)2]Ac��Һ����CO��������������Ӧ�� ��
��4����CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ��ʾ������ͼ��A��BΪ�����ʯī����������ͨ����飬�ڱ�״���£����ļ������VL��0��V��44.8 Lʱ������ܷ�Ӧ����ʽΪ ��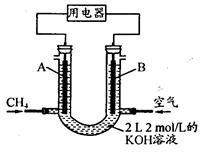
�� 44.8 L��V��89.6 Lʱ�������缫��ӦΪ ��
�� V="67.2" Lʱ����Һ������Ũ�ȴ�С��ϵΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
CO2��CO�ǹ�ҵ�ŷŵĶԻ�������Ӱ��ķ�����
��1����CO2��NH3Ϊԭ�Ϻϳɻ������ص���Ҫ��Ӧ���£�
��2NH3(g)��CO2(g)��NH2CO2NH4(s)����H����159.47 kJ��mol��1
��NH2CO2NH4(s)��CO(NH2)2(s)��H2O(g)����H��a kJ��mol��1
��2NH3(g)��CO2(g)��CO(NH2)2(s)��H2O(g)����H����86.98 kJ��mol��1
��aΪ ��
��2����ѧ��������ù�ҵ�����е�CO2��ȡ�״���CO2+3H2CH3OH+H2O���Ƶõ�CH3OH������ȼ�ϵ�ص�ȼ�ϡ�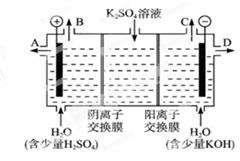
����KOH�����У������ĵ缫��ӦʽΪ_________________________________��
�������ʵ�KOH�����õ��K2SO4��Һ�ķ����Ƶá���KOH��_______���ڵõ�,�����ĵ缫��Ӧʽ�ǣ�_____________________________________��
��3������CO��H2��Ӧ�ɺϳ�CH3OCH3��
��֪��3H2(g) + 3CO(g)  CH3OCH3(g) + CO2(g)����H��-247kJ/mol
CH3OCH3(g) + CO2(g)����H��-247kJ/mol
��һ�������µ��ܱ������У��÷�Ӧ�ﵽƽ�⣬Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� .
| A�����¸�ѹ�� | B����������� | C�����������뺤���� | D������CO��Ũ�ȣ�E������������� |
 CH3OCH3(g) + H2O(g)����ij�¶��£���1L�ܱ������м���CH3OH ����Ӧ��10����ʱ�ﵽƽ�⣬��ʱ��ø���ֵ�Ũ�����£�
CH3OCH3(g) + H2O(g)����ij�¶��£���1L�ܱ������м���CH3OH ����Ӧ��10����ʱ�ﵽƽ�⣬��ʱ��ø���ֵ�Ũ�����£�| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol��L��1�� | 0.01 | 0.2 | 0.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��15�֣����Ŵ�����Ⱦ���������أ��������ڡ�ʮ���塱�ڼ䣬����������(SO2)�ŷ�������8%����������(NOx)�ŷ�������10%��Ŀǰ������������Ⱦ�ж��ַ�����
(1)��CH4����ԭ��������������������������Ⱦ����֪��
��CH4(g)+4NO2(g)��4NO(g) + CO2(g) +2H2O(g) �SH�� -574 kJ��mol��1
��CH4(g) +4NO(g)��2N2(g) + CO2(g) + 2H2O(g) �SH��-1160 kJ��mol��1
��H2O(g)��H2O(l) ��H��-44.0 kJ��mol��1
д��CH4(g)��NO2(g)��Ӧ����N2 (g)��CO2 (g)��H2O(1)���Ȼ�ѧ����ʽ ��
��2������Fe2+��Fe3+�Ĵ����ã������¿ɽ�SO2ת��ΪSO42-���Ӷ�ʵ�ֶ�SO2����������֪��SO2�ķ���ͨ�뺬Fe2+��Fe3+����Һʱ������һ����Ӧ�����ӷ���ʽΪ4Fe2+ + O2+ 4H+ ��4Fe3+ + 2H2O������һ��Ӧ�����ӷ���ʽΪ ��
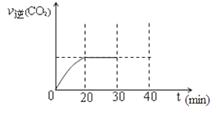
(3)�û���̿��ԭ��������������йط�ӦΪ��C(s)+2NO(g) N2(g)+CO2(g)��ij�о�С�����ܱյ���������У���������������䣬��������������Բ��ƣ�����NO�������Ļ���̿������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)+CO2(g)��ij�о�С�����ܱյ���������У���������������䣬��������������Բ��ƣ�����NO�������Ļ���̿������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
Ũ��/mol��L��1
| NO | N2 | CO2 | ||
| 0 | 1.00 | 0 | 0 | ||
| 10 | 0.58 | 0.21 | 0.21 | ||
| 20 | 0.40 | 0.30 | 0.30 | ||
| 30 | 0.40 | 0.30 | 0.30 | ||
| 40 | 0.32 | 0.34 | 0.17 | ||
| 50 | 0.32 | 0.34 | 0.17 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���û�ѧ��Ӧԭ��֪ʶ�о��������CO��SO2����Ⱦ������Ҫ���塣
��1����CO���Ժϳɼ״�����֪��
CH3OH(g)��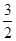 O2(g)=CO2(g)��2H2O(l)����H����764.5 kJ��mol��1
O2(g)=CO2(g)��2H2O(l)����H����764.5 kJ��mol��1
CO(g)��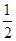 O2(g)=CO2(g)����H����283.0 kJ��mol��1
O2(g)=CO2(g)����H����283.0 kJ��mol��1
H2(g)��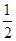 O2(g)=H2O(l)����H����285.8 kJ��mol��1
O2(g)=H2O(l)����H����285.8 kJ��mol��1
��CO(g)��2H2(g)  CH3OH(g)����H��________kJ��mol��1
CH3OH(g)����H��________kJ��mol��1
��2�����д�ʩ���ܹ����������ϳɼ״���Ӧ�ķ�Ӧ���ʵ���________(��д���)��
a��ʹ�ø�Ч���� b�����ͷ�Ӧ�¶�
c��������ϵѹǿ d�����Ͻ�CH3OH�ӷ�Ӧ������з������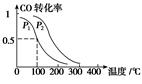
��3����һ��ѹǿ�£��ݻ�ΪV L�������г���a mol CO��2a mol H2���ڴ��������·�Ӧ���ɼ״���ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
��p1________p2(����ڡ�����С�ڡ����ڡ�)��
��100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��________(mol��L��1)��2��
���������������������£�������a mol CO��2a molH2���ﵽ��ƽ��ʱ��CO��ת����________(���������С�����䡱)��
��4��ij����С����SO2Ϊԭ����ȡ���ᡣ
������ԭ���ԭ������SO2��O2��H2O���Ʊ����ᣬ�õ���ö�ײ������缫�������������壬ͬʱҲ��ʹ������������Һ��ֽӴ�����д���õ�صĸ����ĵ缫��Ӧʽ________________��
����Na2SO3��Һ�������SO2��NaHSO3��Һ��Ȼ�������Һ���Ƶ����ᡣ���ԭ��ʾ��ͼ����ͼ��ʾ����д����ʼʱ������Ӧ�ĵ缫��Ӧʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��I����ͼ�ǹ�ҵ��������淋����̡�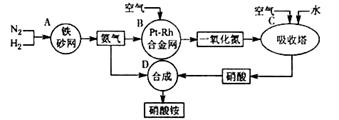
��1��������C��ͨ�������Ŀ���� ��A��B��C��D�ĸ������еķ�Ӧ������������ԭ��Ӧ���� ������ĸ����
��2����֪��4NH3(g) + 3O2(g) = 2N2(g) +6H2O(g) ��H =��1266.8kJ/mol
N2(g) + O2(g) = 2NO(g) ��H =" +180.5" kJ/mol
д�������´��������Ȼ�ѧ����ʽ��
��II��ij����С��ͬѧ��ͭƬ����ϡ���ᣬ���ֿ�ʼʱ��Ӧ�dz�����һ��ʱ���Ӧ�������Լӿ졣��С��ͨ��ʵ��̽����ԭ��
��3���÷�Ӧ�����ӷ���ʽΪ___________________________________________________��
��4������������衣��ʵ���з�Ӧ�������Լӿ��ԭ�������_____________________��
A����Ӧ���ȵ����¶����� B��ѹǿ����
C���������д����� D����Ӧ��Ӵ��������
��5������̽�����ⶨ��Ӧ��������Һ��ͬʱ����¶ȣ�������±���
| ʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| �¶�/�� | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| ʵ�� ��� | ͭƬ ����/g | 0.1mol��L-1�� �������/mL | ����ͭ ����/g | �������� ����/g | ʵ��Ŀ�� |
| �� | 5 | 20 | _______ | _______ | ʵ��ٺ͢�̽��_________��Ӱ�죻ʵ��ٺ͢�̽�����������Ӱ�졣 |
| �� | 5 | 20 | 0.5 | 0 | |
| �� | 5 | 20 | 0 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�Ҵ�����Ҫ�Ļ���ԭ�Ϻ�Һ��ȼ�ϣ�������һ������������CO2��H2��Ӧ�Ƶã�
��ش�
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
��2�����¶�T1>T2ʱ����ѧƽ�ⳣ��K1 K2���>������<����=������
��3���ں��¡����ݵ��ܱ������У�����������˵��������Ӧ�Ѵﻯѧƽ��״̬���� ������ĸ��ţ���
a������1molCH3CH2OH��ͬʱ����3 mol H2O
b�������и����Ũ�Ȳ���ʱ����仯
c�������л��������ܶȲ���ʱ����仯
d������������ķ�����������ʱ����仯
��4���ڹ�ҵ�����У���ʹH2��ת���ʺͻ�ѧ��Ӧ����ͬʱ��ߵĴ�ʩ�� ��д��һ��������ʩ���ɣ���
��5����ҵ�ϣ������Ҵ�Ϊԭ��������ȩ��������ͼ��ʾ��Ϣ���÷�Ӧ�� ��Ӧ������ȡ������ȡ������ж�������__________________��
��6���Ҵ�������Ϊȼ�ϵ�ص�ȼ�ϡ�ij�Ҵ�ȼ�ϵ�����Ҵ�Ϊȼ�ϣ�ʹ�����Ե���ʣ��õ�ظ�����Ӧ�ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״���һ�����͵���Դ��
��1���ϳ��������ΪH2��CO���������״�����Ҫԭ�ϣ���д���ɽ�̿��ˮ�ڸ�������ȡ�ϳ����Ļ�ѧ����ʽ ��
��2����֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ��mol-1��-283.0kJ��mol-1��-726.5kJ��mol-1����״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
��3�����ݻ�Ϊl L���ܱ������У���CO��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ��ע��T1��T2������300�棩��
����˵����ȷ���� ������ţ�
A���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���ƽ������Ϊv(CH3OH)=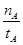 (mol��L-1��min-1) (mol��L-1��min-1) |
| B���÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ�Ĵ� |
| C���÷�ӦΪ���ȷ�Ӧ |
D������A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ ��С ��С |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com