
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+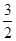 O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+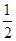 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+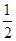 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来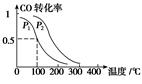
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。
(1)-90.1 (2)ac
(3)①小于 ②(V/a)2 ③增大
(4)①SO2+2H2O-2e-=4H++SO42-
②HSO3-+H2O-2e-=SO42-+3H+
解析试题分析:(1)①CH3OH(g)+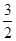 O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1;②CO(g)+
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1;②CO(g)+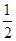 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1;③H2(g)+
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1;③H2(g)+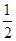 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1;根据盖斯定律,③*2+②-①可得则CO(g)+2H2(g)
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1;根据盖斯定律,③*2+②-①可得则CO(g)+2H2(g)  CH3OH(g) ΔH=-90.1kJ·mol-1。(2)下列措施中能够增大上述合成甲醇反应的反应速率的是a.使用高效催化剂 c.增大体系压强 都能使反应速率加快。:(2)①由图可知,压强不变,温度越高CO的转化率越低,故温度升高平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,所以正反应为放热反应,即△H<0,故答案为:<。 ②100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol。 对于反应 CO(g)+2H2(g)
CH3OH(g) ΔH=-90.1kJ·mol-1。(2)下列措施中能够增大上述合成甲醇反应的反应速率的是a.使用高效催化剂 c.增大体系压强 都能使反应速率加快。:(2)①由图可知,压强不变,温度越高CO的转化率越低,故温度升高平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,所以正反应为放热反应,即△H<0,故答案为:<。 ②100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol。 对于反应 CO(g)+2H2(g)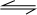 CH3OH(g);
CH3OH(g);
开始(mol):a 2a 0
变化(mol):0.5a a 0.5a
平衡(mol):0.5a a 0.5a
所以平衡时 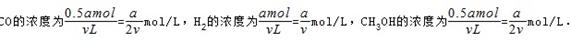
100℃时该反应的平衡常数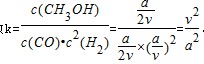 。③温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大。平衡常数只受温度影响,温度不变,平衡常数不变。故答案为:增大;不变。①请写出该电池的负极是失电子的反应,电极反应式SO2+2H2O-2e-=4H++SO42-。②阳极反应是失电子的,元素的化合价升高,根据介质,其电极反应式HSO3-+H2O-2e-=SO42-+3H+。
。③温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大。平衡常数只受温度影响,温度不变,平衡常数不变。故答案为:增大;不变。①请写出该电池的负极是失电子的反应,电极反应式SO2+2H2O-2e-=4H++SO42-。②阳极反应是失电子的,元素的化合价升高,根据介质,其电极反应式HSO3-+H2O-2e-=SO42-+3H+。
考点:本题考查了反应速率、平衡计算与移动、平衡常数等。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:填空题
铜单质及其化合物在工业生产和科研中有重要作用。
(1)已知:2Cu2O(s) + O2(g) = 4CuO(s)△H=-292kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式: ;
(2)现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯: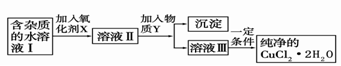
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
| 金属离子 | Fe3+ | Fe2+[来源:学&科& | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)  2NH3(g)△H<0其化学平衡常数K与温度t的关系如右表:请完成下列问题;
2NH3(g)△H<0其化学平衡常数K与温度t的关系如右表:请完成下列问题;
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
 N2(g)+3H2(g)的化学平衡常数的值为 。当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的v(N2)正 __ v(N2)逆(填写“>”、“=”或“<”=)
N2(g)+3H2(g)的化学平衡常数的值为 。当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的v(N2)正 __ v(N2)逆(填写“>”、“=”或“<”=)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。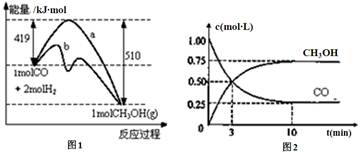
请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g) CH3OH(g)的△H= 。
CH3OH(g)的△H= 。
(2)下列说法正确的是
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,v(CO)= ;达到平衡时,c(H2)= ,该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡 移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡 移动 (填“正向”、“逆向”或“不”)。
(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol
又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“富煤、贫油、少气”是我国能源发展面临的现状。随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。下图是煤化工产业链之一。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol–1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ·mol–1 ②
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= _________kJ·mol–1。在标准状况下,33.6 L的煤炭合成气(设全部为CO和H2)与氧气完全反应生成CO2和H2O,反应中转移______mole-。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形能说明上述反应已达到平衡状态的是_______
a.体系压强保持不变
b.密闭容器中CO、H2、CH3OH(g)3种气体共存
c.CH3OH与H2物质的量之比为1:2
d.每消耗1 mol CO的同时生成2molH2
②CO的平衡转化率(α)与温度、压强的关系如图所示。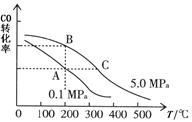
A、B两点的平衡常数_____(填“前者”、“后者”或“一样”)大;达到A、C两点的平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是_____________(答出两点即可)。
(3)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体为正极燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO + H2-4e- + 2CO32-= 3CO2+H2O;则该电池的正极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。
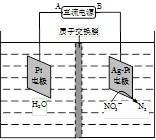
图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ?mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
| A.第10min后,向该容器中再充入1molCO2和3molH2,则再次达到平衡时c(CH3OH) ="1.5" mol/L |
| B.达到平衡时,氢气的转化率为0.75 |
| C.0~10分钟内,氢气的平均反应速率为0.075mol/(L?min) |
| D.该温度下,反应的平衡常数的值为3/16 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
生物质能是一种洁净、可再生能源。生物质气(主要成分为 CO、CO2、H2等)与H2混合,催化合成甲醇和二甲醚(CH3OCH3)及许多烃类物质等,是生物质能利用的方法之一.
(1)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表: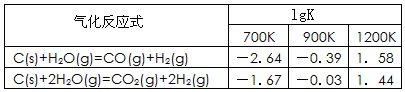
反应:CO(g)+H2O(g)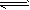 CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
(2)甲醇是一种重要的能源和化工原料,工业上合成甲醇的反应为:CO+2H2?CH3OH.现已知:H2(g)、CO(g)、CH3OH(l)的燃烧热ΔH分别为-285.8KJ/mol、-283.0KJ/mol和-726.5KJ/mol。则:CH3OH不完全燃烧生成CO和液态H2O的热化学反应方程式 .
(3)在一定温度、压强和催化条件下,工业上用CO和H2反应生成二甲醚,同时产生一种参与大气循环的无机物。则该反应的化学反应方程式为: .
(4)下图左为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极上发生反应的电极反应式为 .
(5)连接下图右装置的电源为(4)问中的二甲醚燃料电池。接通电源一段时间后,观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深。则该装置中的Cu电极应与二甲醚燃料电池中 电极(填a或b)相连。通电时发生反应的总的离子反应方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ.mol-1)下表是一些键能数据(kJ·mol-1)
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
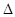 H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1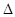 H2= —771.1 kJ·mol-1
H2= —771.1 kJ·mol-1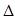 H3=" +482.2" kJ·mol-1
H3=" +482.2" kJ·mol-1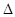 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚( CH3OCH3)。请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) △H= -90.8kJ/mol
CH3OH(g) △H= -90.8kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) 的△H= ;
CH3OCH3(g)+CO2(g) 的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:
________(填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚(CH3OCH3)
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol·L-1) | 0.40 | 0.6 | 0.6 |
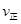 _________
_________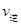 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com