
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
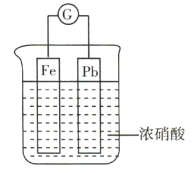
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
![]() 浓硝酸通常保存在棕色试剂瓶中
浓硝酸通常保存在棕色试剂瓶中
![]() 检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
![]() 锌与稀硝酸反应可以得到氢气
锌与稀硝酸反应可以得到氢气
![]() 足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
![]() 浓硫酸滴到纸张上变黑,说明浓硫酸具有脱水性
浓硫酸滴到纸张上变黑,说明浓硫酸具有脱水性
![]() 浓硫酸使胆矾变白,说明浓硫酸具有脱水性
浓硫酸使胆矾变白,说明浓硫酸具有脱水性
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1843年伦敦泰晤士河隧道终于竣工,英国政界人物在隧道里举行了庆典。但带到隧道的香槟酒没有气泡使庆祝变得索然无味,当庆典过后,走出隧道的人们又有尴尬的事发生了:酒在肚子里发胀,酒气从鼻子、嘴里不断冒出来,有的人穿的马甲被胀开。请回答下列问题:
(1)香槟酒、啤酒、碳酸饮料在开瓶时会观察到有气泡冒出,请你写出与该现象有关的化学平衡方程式:_____。
(2)泰晤士河隧道竣工庆典的尴尬说明_____________________对化学平衡移动存在影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制作隐形眼镜的材料应该具有亲水性。聚甲基丙烯酸甲酯(PMMA)是制作隐形眼镜的材料之一。其合成路线如下:
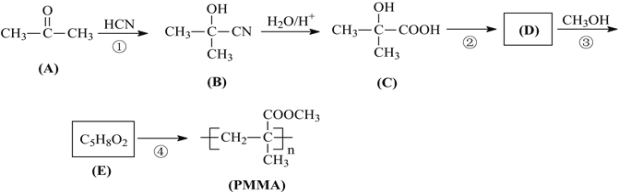
完成下列填空:
(1)写出结构简式:E___;A的一种同分异构体,能与新制氢氧化铜反应,其结构简式为___。
(2)反应①的有机反应类型___。
(3)反应②的试剂和反应条件___。
(4)反应③的化学方程式___。
(5)聚甲基丙烯酸羟乙酯(HEMA)也可制作隐形眼镜(结构简式见图),用HEMA制作的隐形眼镜比PMMA制作的亲水性好,原因是___。
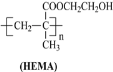
(6)佩戴隐形眼镜最好常滴“人工眼泪”以滋润眼球。有一种“人工眼泪”成分是聚乙烯醇![]() 。已知乙烯醇(CH2=CHOH)不稳定,写出以乙炔为原料(其他无机原料任选)制取聚乙烯醇的合成路线。___。
。已知乙烯醇(CH2=CHOH)不稳定,写出以乙炔为原料(其他无机原料任选)制取聚乙烯醇的合成路线。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业生产食品香精菠萝酯(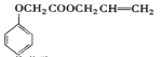 )的简易流程如下:
)的简易流程如下:
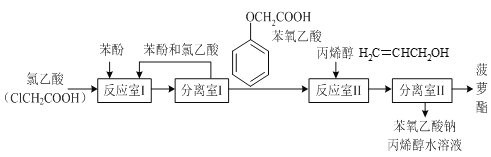
有关物质的熔、沸点如表:
苯酚 | 氯乙酸 | 苯氧乙酸 | |
熔点/℃ | 43 | 62 | 99 |
沸点/℃ | 181.9 | 189 | 285 |
试回答下列问题:
(1)反应室I中反应的最佳温度是104℃,为较好地控制温度在102℃~106℃之间,加热时可选用___(选填字母)。
A.火炉直接加热 B.水浴加热 C.油浴加热
(2)分离室I采取的操作名称是___。
(3)反应室I中发生反应的化学方程式是___。
(4)分离室II的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是___(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全气囊是行车安全的重要设施,当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客的安全。为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究。经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、O四种元素。
(1)氧元素在元素周期表中的位置是__________,Na原子的结构示意图为__________,Na、Fe、N、O四种元素中三种主族元素的离子半径从大到小的顺序是__________(用离子符号表示)。
(2)水溶性实验表明,安全装置中固体粉末部分溶解。不溶物为一种红棕色固体,可溶于盐酸。已知该不溶物能发生铝热反应,写出该反应的化学方程式:___________。
(3)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐中含有的化学键类型是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)=C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。
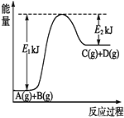
(1)该反应是_____(填“吸热”或“放热”)反应,该反应的ΔH=________kJ/mol (用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量______(填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1_______,E2________ΔH______ (填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com