
【题目】实验室模拟工业生产食品香精菠萝酯(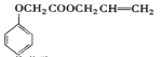 )的简易流程如下:
)的简易流程如下:
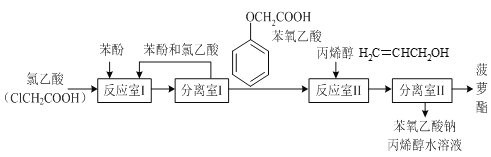
有关物质的熔、沸点如表:
苯酚 | 氯乙酸 | 苯氧乙酸 | |
熔点/℃ | 43 | 62 | 99 |
沸点/℃ | 181.9 | 189 | 285 |
试回答下列问题:
(1)反应室I中反应的最佳温度是104℃,为较好地控制温度在102℃~106℃之间,加热时可选用___(选填字母)。
A.火炉直接加热 B.水浴加热 C.油浴加热
(2)分离室I采取的操作名称是___。
(3)反应室I中发生反应的化学方程式是___。
(4)分离室II的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是___(用化学方程式表示)。
【答案】C 蒸馏 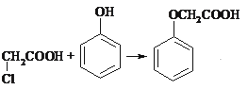 +HCl
+HCl 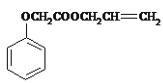 +NaOH
+NaOH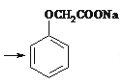 +HOCH2CH=CH2
+HOCH2CH=CH2
【解析】
用苯氧乙酸和丙烯醇发生酯化反应制得菠萝酯,苯氧乙酸用苯酚和氯乙酸反应制得,考虑到它们溶沸点的差异,最好选择温度让苯酚,氯乙酸,苯氧乙酸都成为液体,反应室I中反应的最佳温度是104℃,水浴加热温度太低,苯氧乙酸沸点99摄氏度,水浴温度会使它凝固,不利于分离,火炉直接加热,会使苯酚,氯乙酸,苯氧乙酸全都生成气体,不利于反应,故选择油浴。生成的菠萝酯属于酯类,在碱性条件下会发生水解,所以不能用NaOH溶液代替NaHCO3溶液。
(1)火炉直接加热温度比较高,会让苯酚和氯乙酸变成蒸汽,不利于它们之间的反应,还会使苯氧,故温度不能太高,水浴加热温度较低,不能让氯乙酸和苯酚熔化,故温度也不能太低,可以使所有物质都成液体,为较好地控制温度在102℃~106℃之间,加热时可选用油浴加热,
答案为:C;
(2)分离室I是将反应不充分的原料再重复使用,为了增加原料的利用率,要把苯酚和氯乙酸加入反应室1,操作名称为蒸馏;
答案为:蒸馏;
(3)反应室1为苯酚和氯乙酸发生取代反应,制得苯氧乙酸, +HCl,
+HCl,
答案为: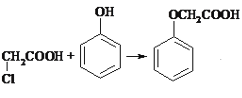 +HCl;
+HCl;
(4)分离室II发生的反应是苯氧乙酸和丙烯醇发生酯化反应,制取菠萝酯,由于酯在NaHCO3溶液中的溶解度较小,可以析出,随后分液即可,如用NaOH会使酯发生水解,故不能用NaOH溶液代替NaHCO3溶液,化学方程式为 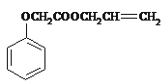 +NaOH
+NaOH +HOCH2CH=CH2
+HOCH2CH=CH2
答案为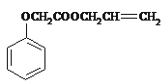 +NaOH
+NaOH +HOCH2CH=CH2。
+HOCH2CH=CH2。


科目:高中化学 来源: 题型:
【题目】以黄铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
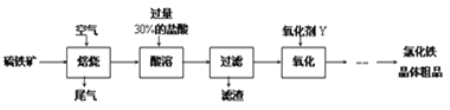
请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是______________________________________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是_____________、__________.
(3)尾气主要含N2、O2、SO2和少量的CO2、H2O(g).测定尾气中SO2含量的方案如下:
(方案甲)将标准状况下的2.24 L尾气缓慢通过如下装置A中:
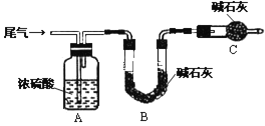
①C仪器的名称是_______________,装置C的作用是_________________________.
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,请写出该方案合理与否的理由__________________________________________.
(方案乙)将标准状况下的2.24 L尾气缓慢通过如下装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、用电子天平称得沉淀质量为0.233g.
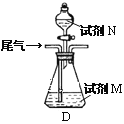
③若试剂M、N分别是碘水、BaCl2溶液,写出D中总反应的离子方程式: __________________.尾气中SO2的体积分数为__________________.
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色.写出SO2和Ba(NO3)2溶液反应的离子方程式:___________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子反应的说法正确的是( )
选项 | 离子方程式 | 评价 |
A | 将2molCl2通入到含1mol FeI2的溶液中:2Fe2++2I-+2Cl2= 2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ | 正确;阳极氯离子放电,阴极氢离子放电 |
C | 向AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O=A1O2一 + 4NH4++ 2H2O | 正确;氨水过量,氢氧化铝能溶于过量的碱 |
D | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | 错误;电荷不守恒,生成物中应有亚铁离子 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L的氨水,所得溶液pH及导电性变化如图。下列分析正确的是
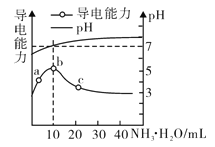
A. a~c点,溶液中离子数目先增大后减小
B. b点溶液pH=7说明c(NH4+)=c(R-)
C. c点溶液存在c(NH4+)>c(R-)>c(H+)>c(OH-)
D. b、c两点对应溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )

A. 铜片上的电极反应:Cu — 2e﹣ = Cu2+
B. 锌片为电池的负极
C. 外电路中电子由铜片经导线流向锌片
D. 电池工作时电能直接转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
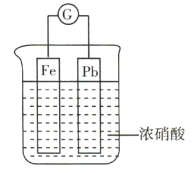
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不符合节能减排要求的是( )
A.将煤块粉碎提高燃料的燃烧效率
B.在汽车上安装汽车尾气催化转化装置,可使汽车尾气中的![]() 和
和![]() 发生反应:
发生反应:![]()
C.在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃料电池汽车
D.在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度下,有下列反应发生:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),该反应的平衡常数表达式K=________。
(2)在配制FeCl3溶液时,加入少许浓盐酸,其目的是:_____________;不断加热FeCl3溶液,蒸干其水分并灼烧固体,最后得到的物质是________。
(3)已知:Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+![]() O2(g)===Fe2O3(s)的ΔH是____________________。
O2(g)===Fe2O3(s)的ΔH是____________________。
(4)Fe(OH)2在空气中短时间内可被氧化为Fe(OH)3,发生的反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,下列说法中错误的是________(填字母)。
A.该反应是能自发进行的反应
B.该反应是熵增加的反应
C.该反应是化合反应
D.该反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列说法正确的是
A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=a+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH<7
C.NH4Cl溶液的Kw大于NaCl溶液的Kw
D.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中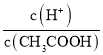 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com