
【题目】氮的氧化物和氮的氢化物的任意排放均会对环境造成污染,因此关于其转化的研究对于消除环境污染有着重要意义。
(1)已知T℃时,有如下反应:
反应I:4NH3(g) + 6NO(g)![]() 5N2 ( g) + 6H2O(g) △H = -1804 kJmol-1
5N2 ( g) + 6H2O(g) △H = -1804 kJmol-1
反应II:N2(g) +2O2(g) ![]() 2NO2(g) △H = +67.8 kJmol-1
2NO2(g) △H = +67.8 kJmol-1
反应III:2NO(g) + O2 (g) ![]() 2 NO2 (g) △H =-116.2 kJmol-1
2 NO2 (g) △H =-116.2 kJmol-1
试写出T℃ 时,NH3与NO2反应生成不污染环境的物质的热化学反应方程式 ______。
(2)T℃时,向2L密闭容器中加入一定量的NO2、NO和O2,发生(1)中反应III,不同时间测得各物质的部分浓度(molL-1) 如下表所示:
时间( min) | NO | O2 | NO2 |
0 | a | 0.30 | 0.10 |
10 | 0.14 | 0.27 | b |
20 | 0.10 | c | 0.20 |
30 | d | 0.24 | 0.22 |
40 | 0.08 | e | f |
①温度不变,反应达平衡后容器中的压强与最初加入气体时的压强之比为_______。
②反应的前 20 min 的平均反应速率v(NO)=________molL-1·min-1。
③若温度不变,平衡后将反应容器压缩为1L,达到新的平衡后,c(O2)_____0.48molL-1(填“>”“<”或“ =”)。
(3)某化学兴趣小组利用电解原理设计实验消除NH3 与 NO对环境的影响, 并制取KOH溶液和H2SO4溶液,其工作原理如下图所示:
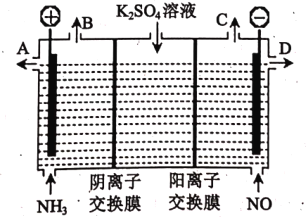
①从出口B、C产生的气体相同,该气体是_____:从出口 D 得到的溶液是____。
②电解槽左池中发生的电极反应式为________ 。
③电解一段时间,两电极共收集到22.4L气体(标准状况下)时,理论上将生成____________mol KOH。
【答案】8NH3(g) + 6NO2(g)![]() 7N2(g) + 12H2O(g) H = -2707.4 kJmol1 9∶10 0.005 < N2 或氮气 KOH 溶液 2NH3 - 6e = N2↑ + 6H+ 2.4
7N2(g) + 12H2O(g) H = -2707.4 kJmol1 9∶10 0.005 < N2 或氮气 KOH 溶液 2NH3 - 6e = N2↑ + 6H+ 2.4
【解析】
(1)根据盖斯定律I×2-III×6+II×3可得目标热化学方程式;
(2)先根据表格数据结合反应III方程式判断起始时NO的物质的量浓度,进而根据30min及40min的数据判断平衡状态并进行相关计算;
(3)根据装置图先判断电解池的阴极和阳极,再结合两极通入的物质判断相关的产物和电极反应式。
(1)已知T℃时,有如下反应:
反应I:4NH3(g) + 6NO(g)![]() 5N2 ( g) + 6H2O(g) △H = -1804 kJmol-1
5N2 ( g) + 6H2O(g) △H = -1804 kJmol-1
反应II:N2(g) +2O2(g) ![]() 2NO2(g) △H = +67.8 kJmol-1
2NO2(g) △H = +67.8 kJmol-1
反应III:2NO(g) + O2 (g) ![]() 2 NO2 (g) △H =-116.2 kJmol-1
2 NO2 (g) △H =-116.2 kJmol-1
根据盖斯定律,I×2-III×6+II×3可得NH3与NO2反应生成不污染环境的物质即N2和H2O的热化学反应方程式为8NH3(g) + 6NO2(g)![]() 7N2(g) + 12H2O(g) H = -2707.4 kJmol1;
7N2(g) + 12H2O(g) H = -2707.4 kJmol1;
(2)①T℃时,向2L密闭容器中加入一定量的NO2、NO和O2,发生反应2NO(g) + O2 (g) ![]() 2 NO2(g),0~10min时间段内,O2的物质的量浓度减少了0.03mol/L,则相同时间内NO的物质的量浓度减少0.06mol/L,所以NO的起始物质的量浓度为0.14mol/L+0.06mol/L=0.20mol/L;30min时O2的物质的量浓度为0.24mol/L,说明0~30min时间段内O2的物质的量浓度减少了0.06mol/L,则相同时间内NO的物质的量浓度减少0.12mol/L,即d为0.08mol/L,因40min时NO的物质的量浓度也为0.08mol/L,说明30min时反应达到平衡状态;温度不变,反应达平衡后容器中的压强与最初加入气体时的压强之比等于平衡时各气体物质的量之和与最初加入气体时的物质的量之和的比值,即比值为
2 NO2(g),0~10min时间段内,O2的物质的量浓度减少了0.03mol/L,则相同时间内NO的物质的量浓度减少0.06mol/L,所以NO的起始物质的量浓度为0.14mol/L+0.06mol/L=0.20mol/L;30min时O2的物质的量浓度为0.24mol/L,说明0~30min时间段内O2的物质的量浓度减少了0.06mol/L,则相同时间内NO的物质的量浓度减少0.12mol/L,即d为0.08mol/L,因40min时NO的物质的量浓度也为0.08mol/L,说明30min时反应达到平衡状态;温度不变,反应达平衡后容器中的压强与最初加入气体时的压强之比等于平衡时各气体物质的量之和与最初加入气体时的物质的量之和的比值,即比值为![]() = 9∶10;
= 9∶10;
②反应的前 20 min 的平均反应速率v(NO)=![]() =0.005molL-1·min-1;
=0.005molL-1·min-1;
③温度不变,平衡后将反应容器压缩为1L,若平衡不移动,则c(O2)等于0.48molL-1,而缩小容器体积时压强增大,平衡正向移动,所以达到新的平衡后,c(O2)小于0.48molL-1;
(3)据图可知,电解池左端连接外加电源的正极,为电解池的阳极,发生的电极反应为2NH3 - 6e = N2↑ + 6H+,硫酸根离子通过阴离子交换膜进入左侧,与氢离子结合得硫酸溶液,右端连接外加电源的负极,为电解池的阴极,发生的电极反应为2NO +2H2O+4e = N2↑ + 4OH-,钾离子通过阳离子交换膜进入右侧与氢氧根离子结合得KOH溶液;
①根据电极反应式可知,从出口B、C产生的气体相同,均为氮气,从出口D
②根据分析可知,电解槽左池为阳极,发生的电极反应式为2NH3 - 6e = N2↑ + 6H+;
③根据得失电子守恒,相同时间内电解池阳极和阴极产生的氮气比为2∶3,当电解一段时间,两电极共收集到标准状况下22.4L气体即1mol气体时,阴极生成的氮气为0.6mol,根据阴极反应式2NO +2H2O+4e = N2↑ + 4OH-可知,理论上将生成0.6mol×4=2.4mol KOH。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
选项 | 操作及现象 | 结论 |
A | 加入AgNO3溶液,生成白色沉淀,再加稀盐酸沉淀不溶解 | 原溶液中有Cl-存在 |
B | 通入Cl2后,溶液变为深黄色,继续加入淀粉溶液后溶液变蓝 | 原溶液中有I-存在 |
C | 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时 | 原溶液中有 |
D | 加入稀盐酸,生成的气体能使澄清石灰水变浑浊 | 原溶液中有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯) | ________。 | ________。 |
(Ⅱ)酒精(水) | ________。 | ________。 |
①检验试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液
C.水 D.氢氧化钠溶液
②除杂试剂:
a.无水硫酸铜 b.乙酸
c.新制的生石灰 d.溴水
除杂时,乙烯发生反应的化学方程式为____________________。
(2)如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
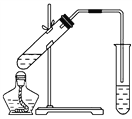
试回答:
在右试管中通常加入________溶液,实验生成的乙酸乙酯,其密度比水________,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为(只填名称)________。反应中加入浓硫酸的作用是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )
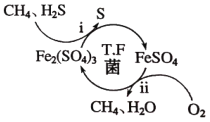
A.Fe2(SO4)3可以视为该脱硫过程中的催化剂
B.该脱硫过程的总反应为:2H2S+O2=2S+2H2O
C.该脱硫过程不能在高温下进行
D.该脱硫过程是将H2S转化为FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性介质中,H2O2能使 KMnO4溶液褪色,离子反应(未配平)为:MnO![]() + H+ + H2O2→Mn2++ O2 + H2O,下列说法错误的是
+ H+ + H2O2→Mn2++ O2 + H2O,下列说法错误的是
A.氧化性比较:MnO![]() > O2
> O2
B.该反应中酸性介质可以为盐酸
C.氧化剂与还原剂的物质的量之比为2∶5
D.若有0.1 mol氧化产物生成, 则转移电子0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至60℃,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料。
Ⅰ、某学习小组同学设计了下图所示的实验装置(部分夹持仪器未画出),进行氨气实验室制备且探究氨气的还原性及产物的检验。
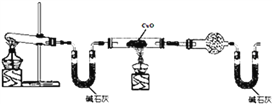
实验现象为:黑色CuO变为红色;干燥管中无水CuSO4粉末变为蓝色;同时生成一种无色无味无污染的气体。
(1)请写出大试管中反应的化学方程式_______________________________________。
(2)请写出氨气与CuO反应的化学方程式_________________________________________。
(3)该装置存在明显缺陷,请指出存在的问题______________________。
Ⅱ、哈伯因为将氮气和氢气在一定条件下合成氨气的成果面获得1918年诺贝尔化学奖。现将1molN2和3molH2充入一恒容的密闭容器中,使其在一定条件下达到平衡N2+3H2![]() 2NH3,下列哪些状态一定是达到平衡的状态?(_____)
2NH3,下列哪些状态一定是达到平衡的状态?(_____)
A.混合气体的平均相对分子质量不随时间改变而改变的状态
B.N2、H2、NH3的总物质的量不随时间改变而改变的状态
C.混合气体的密度不随时间改变而改变的状态
D.单位时间内0.1molNH3分解的同时,有0.05molN2生成的状态
Ⅲ、下图是一种电化学制备NH3的装置,图中陶瓷在高温时可以传输H+。
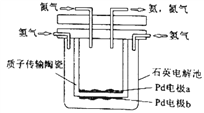
(1)H+经质子传输陶瓷由_____________流向_______________。(选填“a”或“b”)
(2)阴极发生的电极反应为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
(1)CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H=________kJ/mol
(2)某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)=_______,计算此条件下该反应的平衡常数K= __________。
(3)捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
①下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
②用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
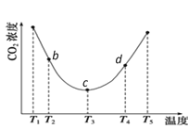
I. c点的逆反应速率和d点的正反应速率的大小关系为
V逆c _____V正d (填“>”、“=”或“<”)
II. b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为_______。(填“>”、“=”或“<”)
III.T3~T4温度区间,容器内CO2气体浓度呈现增大的变化趋势,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是_____(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是_______(填化学式),反应的化学方程式为_________。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有___________(填序号)。
A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液_______,说明这种气体具有_______性;将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:__________________________________________。
(5)能否用澄清石灰水鉴别这两种气体?_______(填“能”或“不能”),若不能,请填写两种能鉴别的试剂____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com