
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1
2H2(g)+O2(g)===2H2O(g) ΔH2
C(s)+O2(g)===CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
A.12ΔH3+5ΔH2-2ΔH1 B.2ΔH1-5ΔH2-12ΔH3
C.12ΔH3-5 ΔH2-2ΔH1 D.ΔH1-5ΔH2-12ΔH3
ΔH2-2ΔH1 D.ΔH1-5ΔH2-12ΔH3
科目:高中化学 来源: 题型:
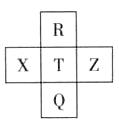 元素R、X、T、Z、Q在元素周期表
元素R、X、T、Z、Q在元素周期表 中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )
A.1.7 B.2.0 C.12.0 D.12.4
查看答案和解析>>
科目:高中化学 来源: 题型:
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式______________________________________。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为________个、________个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子、离子化学式分别为________、________(各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图2所示。
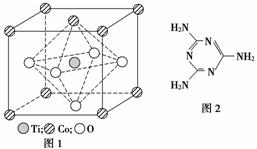
三聚氰胺分子中氮原子轨道杂化类型是________,1 mol三聚氰胺分子中σ键的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH2=-1 160 kJ·mol-1
若在标准状况下用CH4还原4.48 L NO2气体至N2,则下列说法中正确的是
A.该过程吸收的热量为86.7 kJ
B.此过程中需要CH4气体1.12 L
C.转移的电子数为0.8NA个
D.已知2NO(g)+O2(g)===2NO2(g) ΔH=-114 kJ·mol-1,则CH4的燃烧热是802 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是某条件时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
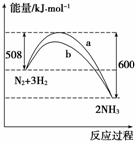
A.该反应的热化学方程式为:N2+3H2 2NH3 ΔH=-92 kJ·mol-1
2NH3 ΔH=-92 kJ·mol-1
B.正反应的活化能大于逆反应的活化能
C.b曲线是加入催化剂时的能量变化曲线
D.使用催化剂能改变反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 化学方程式 | 焓变ΔH (kJ·mol-1) | |
| 甲烷 氧化 | CH4(g)+2O2(g)===CO2(g)+2H2O(g) | ΔH1 |
| CH4(g)+O2(g)===CO2(g)+2H2(g) | -322.0 | |
| 蒸汽 重整 | CH4(g)+H2O(g)===CO(g)+3H2(g) | 206.2 |
| CH4(g)+2H2O(g)===CO2(g)+4H2(g) | 165.0 |
①反应CO(g)+H2O(g)===CO2(g)+H2(g)的ΔH=________ kJ·mol-1。
②甲烷的燃烧热为ΔH2,则ΔH2________ΔH1(填“>”、“=”或“<”)。
(2)物质(tBuNO)2在正庚烷溶剂中发生如下反应:
(tBuNO)22(tBuNO) ΔH。
实验测得该反应的ΔH=+50.5 kJ·mol-1,活化能Ea=90.4 kJ·mol-1。下列能量关系图合理的是________________________________________________________________________。
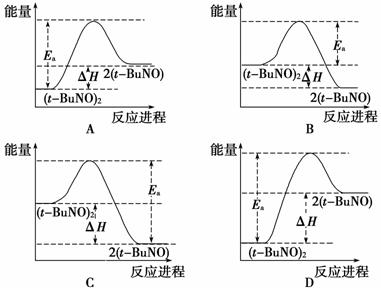
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种溶液中各含一种X-(X-为Cl-、Br-或I-)离子,向甲溶液中加淀粉溶液和新制的氯水变为橙色,将此溶液倒入丙中,颜色无明显变化,则甲、乙、丙依次含有
A.Br-、Cl-、I- B.Br-、I-、Cl- C.I-、Br-、Cl- D.Cl-、I-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是________(填序号)。
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
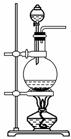 (2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
①判定甲方案不可行,理由是____________。
②进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0.100 0 mol·L-1NaOH标准溶液滴定,消耗22.00 mL,该次滴定测得试样中盐酸浓度为____________mol·L-1;
b.平行滴定后获得实验结果。
③判断丙方案的实验结果________(填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11]
 ④进行丁方案实验:装置如图所示(夹持器具已略去)。
④进行丁方案实验:装置如图所示(夹持器具已略去)。
(i)使Y形管中的残余清液与锌粒反应的正确操作是将________转移到________中。
(ii)反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是________(排除仪器和实验操作的影响因素)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com