
【题目】写出下列反应的化学方程式,并注明(1)、(2)、(3)的反应类型
(1)由乙烯制备聚乙烯的反应 _______________反应类型:_________________
(2)用甲苯制TNT的反应 __________________反应类型:_________________
(3)溴乙烷与NaOH的乙醇溶液共热 _________________反应类型:_____________
(4)烯烃在一定条件下氧化时,由于C=C键断裂,转化为醛、酮,如:![]() 。若
。若![]() 在上述类似条件下发生反应,请写出反应的方程式 _________________________ 。
在上述类似条件下发生反应,请写出反应的方程式 _________________________ 。
【答案】nCH2=CH2![]()
![]() 加聚反应
加聚反应 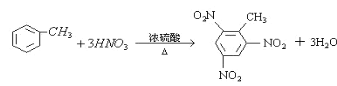 取代反应 CH3CH2Br+NaOH
取代反应 CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr+H2O 消去反应
CH2=CH2↑+NaBr+H2O 消去反应 ![]() +O2→2
+O2→2![]()
【解析】
根据有机物的结构特点和反应条件书写方程式并判断反应类型。
(1)乙烯含有碳碳双键,可发生加聚反应生成聚乙烯,方程式为nCH2=CH2![]()
![]() ,答案:nCH2=CH2
,答案:nCH2=CH2![]()
![]() ;加聚反应;
;加聚反应;
(2)甲苯与浓硝酸发生取代反应可生成TNT,即三硝基甲苯,反应的化学方程式为 ;答案:
;答案: ;取代反应;
;取代反应;
(3)溴乙烷与NaOH的乙醇溶液共热发生消去反应,反应的方程式为:CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr+H2O ;答案:CH3CH2Br+NaOH
CH2=CH2↑+NaBr+H2O ;答案:CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr+H2O;消去反应;
CH2=CH2↑+NaBr+H2O;消去反应;
(4)烯烃在一定条件下氧化时,由于C=C键断裂,转化为醛、酮,若![]() 在上述类似条件下发生反应,双键断裂被氧化,反应的方程式为
在上述类似条件下发生反应,双键断裂被氧化,反应的方程式为![]() +O2→2
+O2→2 ![]() ;答案:
;答案:![]() +O2→2
+O2→2 ![]() 。
。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
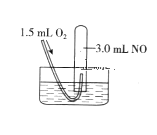
【题目】如图所示,室温下向盛有3.0mL NO的试管中缓缓通入1.5mL O2(所有气体的体积均在标准状况下测定)。
试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①__________;
②__________;
③__________。
(2)上述过程中发生反应的化学方程式有__________。
(3)最终试管中剩余的气体是__________,体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国成功研制出高效电催化固氮催化剂Mo2N,如图所示,在0.1mol·L-1盐酸溶液中,在一定电压下具有较高的产氨速率和稳定的电流效率。下列判断错误的是
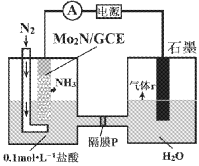
A. 石墨电极为阳极
B. P为阳离子交换膜
C. Mo2N/GCE电极区反应式为N2+6H++6e-=2NH3
D. 为提高溶液的导电性,可在石墨电极区加入适量的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NH4Cl溶液显_________性,用离子方程式表示原因____________,其溶液中离子浓度大小顺序为_______________________________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=________ ,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_________________。
(3)若将等pH、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m__________n(填“<”、“>”或“=”)。
(4)物质的量浓度相同的NaCl;NaOH;HCl;④NH4Cl;⑤CH3COONa 5种溶液按pH由大到小的顺序为(用④⑤代表相应溶液):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无机矿物资源生产部分材料,其生产流程如图.下列有关说法不正确的是![]()
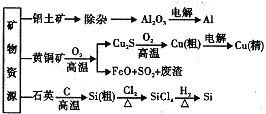
A.![]() 、
、![]() 均为共价化合物
均为共价化合物
B.生产过程中均涉及氧化还原反应
C.石英可用于制光导纤维,晶体Si常用做半导体材料
D.黄铜矿冶炼铜时产生的![]() 可用于生产硫酸,FeO可用于冶炼铁
可用于生产硫酸,FeO可用于冶炼铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡![]() 熔点
熔点![]() 与
与![]() 反应制备
反应制备![]() ,装置如图。
,装置如图。
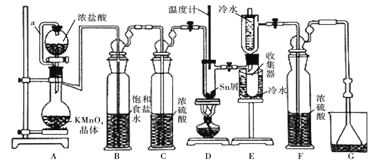
已知:![]() 、
、![]() 有关物理性质:
有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
![]() 极易水解生成
极易水解生成![]() 。回答下列问题:
。回答下列问题:
(1)导管a的作用是____________,装置A中发生反应的离子方程式为____________________。
(2)当观察到装置F液面上方___________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是![]() ________;
________;![]() ______
______
(3)若上述装置中缺少装置![]() 其它均相同
其它均相同![]() ,则D处具支试管中发生的主要副反应化学方程式为_________________________________。
,则D处具支试管中发生的主要副反应化学方程式为_________________________________。
(4)![]() 和锡的反应产物有
和锡的反应产物有和
![]() ,为防止产品中带入过多的
,为防止产品中带入过多的![]() ,可采取的措施是____________________________________________。
,可采取的措施是____________________________________________。
(5)滴定分析产品中2价![]() Ⅱ
Ⅱ![]() 的含量:用分析天平称取
的含量:用分析天平称取![]() 产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用
产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用![]() 的碘标准溶液滴定至终点时消耗
的碘标准溶液滴定至终点时消耗![]() ,则产品中
,则产品中![]() Ⅱ
Ⅱ![]() 的质量分数为___________。
的质量分数为___________。![]() 小数点后保留2位,已知
小数点后保留2位,已知![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体![]() 是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
I、制备草酸亚铁晶体:
![]() 称取硫酸亚铁铵晶体
称取硫酸亚铁铵晶体![]() ,放入
,放入![]() 三颈烧瓶中,加入10滴左右
三颈烧瓶中,加入10滴左右![]() 溶液和
溶液和![]() 蒸馏水加热溶解;
蒸馏水加热溶解;
![]() 加入
加入![]() 饱和草酸溶液,加热搅拌至沸,停止加热,静置;
饱和草酸溶液,加热搅拌至沸,停止加热,静置;
![]() 待黄色晶体
待黄色晶体![]() 沉淀后倾析,洗涤,加入约
沉淀后倾析,洗涤,加入约![]() 蒸馏水搅拌并温热
蒸馏水搅拌并温热![]() ,静置,弃去上层清液,即得黄色草酸亚铁晶体。
,静置,弃去上层清液,即得黄色草酸亚铁晶体。
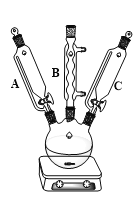
回答下列问题:
(1)仪器C的名称是_____________;仪器B的作用是_____________
(2)硫酸亚铁铵晶体用硫酸溶解的原因是 _____________________
II、探究草酸亚铁的纯度:
![]() 准确称取
准确称取![]() 草酸亚铁固体样品
草酸亚铁固体样品![]() 含有草酸铵杂质
含有草酸铵杂质![]() ,溶于
,溶于![]() 溶液中,在
溶液中,在![]() 水浴加热,用
水浴加热,用![]() 容量瓶配成
容量瓶配成![]() 溶液;
溶液;
![]() 取上述溶液
取上述溶液![]() ,用
,用![]() 标准溶液
标准溶液![]() 浓度为
浓度为![]() 滴定三次,平均消耗
滴定三次,平均消耗![]() ;
;
![]() 加入适量锌粉和
加入适量锌粉和![]() 溶液,反应一段时间后,取1滴试液放在点滴板上检验,至
溶液,反应一段时间后,取1滴试液放在点滴板上检验,至![]() 极微量;
极微量;
![]() 过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约
过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约![]() 溶液,继续用
溶液,继续用![]() 标准溶液
标准溶液![]() 浓度为
浓度为![]() 滴定至终点,共平行测定三次,平均消耗
滴定至终点,共平行测定三次,平均消耗![]() 。
。
回答下列问题:
(3)在![]() 中溶液中发生
中溶液中发生![]() ,还有另一氧化还原反应,写出其离子方程式_______________________,用
,还有另一氧化还原反应,写出其离子方程式_______________________,用![]() 标准溶液滴定至终点的现象是__________________。
标准溶液滴定至终点的现象是__________________。
(4)加入适量锌粉的目的是______________________________________;步骤![]() 中检验其中微量的
中检验其中微量的![]() 的试剂名称是______________溶液
的试剂名称是______________溶液
(5)计算![]() 固体样品的纯度为______________
固体样品的纯度为______________![]() 用含c、
用含c、![]() 、
、![]() 的式子表示,不必化简
的式子表示,不必化简![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器中发生如下反应2A(g)+B(g)![]() 2C(g),若开始时充入2molC气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molA和1molB的混合气体,达到平衡时A的转化率为( )
2C(g),若开始时充入2molC气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molA和1molB的混合气体,达到平衡时A的转化率为( )
A.20%B.40%C.60%D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com