
【题目】某温度下,在密闭容器中发生如下反应2A(g)+B(g)![]() 2C(g),若开始时充入2molC气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molA和1molB的混合气体,达到平衡时A的转化率为( )
2C(g),若开始时充入2molC气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molA和1molB的混合气体,达到平衡时A的转化率为( )
A.20%B.40%C.60%D.80%
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.书写共价化合物的电子式只需把结构式中的一个单键改成一对电子即可
B.已知![]() ,可见,成键的一方不提供电子也可能形成化学键
,可见,成键的一方不提供电子也可能形成化学键
C.将某种化合物溶于水,若能导电说明这种化合物是离子化合物
D.只要是离子化合物其熔点就比共价化合物的熔点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并注明(1)、(2)、(3)的反应类型
(1)由乙烯制备聚乙烯的反应 _______________反应类型:_________________
(2)用甲苯制TNT的反应 __________________反应类型:_________________
(3)溴乙烷与NaOH的乙醇溶液共热 _________________反应类型:_____________
(4)烯烃在一定条件下氧化时,由于C=C键断裂,转化为醛、酮,如:![]() 。若
。若![]() 在上述类似条件下发生反应,请写出反应的方程式 _________________________ 。
在上述类似条件下发生反应,请写出反应的方程式 _________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为反应 2H2(g)+O2(g)=2H2O(g)的能量变化示意图。 下列说法正确的是
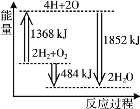
A.拆开 2 mol H2(g)和 1 mol O2(g)中的化学键成为H、O原子,共放出1368 kJ 能量
B.由 H、O 原子形成 2 mol H2O(g),共吸收1852 kJ 能量
C.2 mol H2(g)和 1 mol O2(g)反应生成 2 mol H2O(g),共放出484 kJ 能量
D.2 mol H2(g)和 1 mol O2(g)反应生成 2 mol H2O(l),ΔH>-484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋![]() 及其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为
及其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为![]() ,含杂质
,含杂质![]() 、
、![]() 等)制备
等)制备![]() 的工艺如下(已知水解能力:
的工艺如下(已知水解能力:![]() )
)
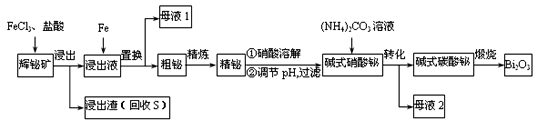
回答下列问题:
(1)为了提高浸出率,可采取的措施有_______________。(任写一条)
(2)“浸出”时![]() 与
与![]() 溶液反应的化学方程式为__________________________,盐酸的作用_________________________________________。
溶液反应的化学方程式为__________________________,盐酸的作用_________________________________________。
(3)“母液2”中主要溶质的化学式为________。
(4)“粗铋”中含有的主要杂质是Pb,可通过电解精炼除杂。电解质为熔融![]() 、KC1,电解后精铋留在粗铋电极下方电解槽底部。电解时,粗铋与电源_____(填“正”或“负”)极相连。阴极的电极反应为__________________________,铅元素的金属性比铋元素______。(填“强”“弱”或“不能确定”)。
、KC1,电解后精铋留在粗铋电极下方电解槽底部。电解时,粗铋与电源_____(填“正”或“负”)极相连。阴极的电极反应为__________________________,铅元素的金属性比铋元素______。(填“强”“弱”或“不能确定”)。
(5)碱式硝酸铋直接灼烧也能得到![]() ,上述工艺中转化为碱式碳酸铋再灼烧的优点是_________。
,上述工艺中转化为碱式碳酸铋再灼烧的优点是_________。
(6)常温下,向浓度均为![]() 的
的![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液,先生成__________沉淀,通过计算说明______________________________。[已知:Ksp(PbS) = 3.0×10-28,Ksp(Bi2S3) = 1.0×10-20]
溶液,先生成__________沉淀,通过计算说明______________________________。[已知:Ksp(PbS) = 3.0×10-28,Ksp(Bi2S3) = 1.0×10-20]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某铁碳合金(可看作铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中碳的质量分数,设计了如图所示的实验装置(夹持仪器已省略)。
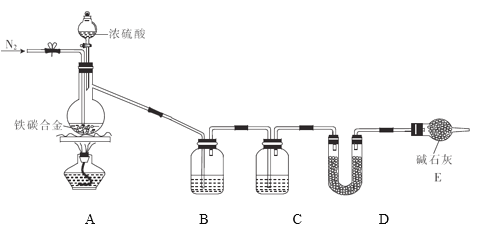
(1)装置A中发生的反应除外![]() ,还有________________。
,还有________________。
(2)请完成下列表格:
装置代号 | B | C | D |
所盛试剂 | 酸性 | ①________ | ②____________ |
装置作用 | ③_____________ | 干燥气体 | ④___________ |
(3)若铁碳合金的质量为5.00g,充分反应后称得D装置增重0.66g,则合金中碳的质量分数为_______,若缺少E装置,则所测碳的质量分数_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka___(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___(填序号)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)用蒸馏水稀释0.1mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是___(填序号)。
a.![]() b.
b.![]()
c. ![]() d.
d.![]()
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液c(H2CO3)___c(CO32-)(填“>、<或=”),原因是___。
(5)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中:
①![]() =___(填“精确数值”,下同)。
=___(填“精确数值”,下同)。
②c(CH3COO-)-c(Na+)=___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作合理或能达到实验目的的是
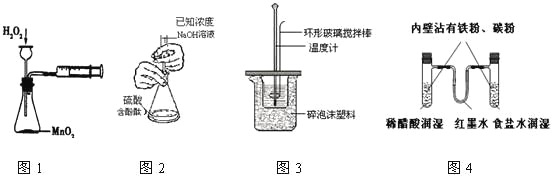
A.图1:实验目的是定量测定化学反应速率
B.图2:用标准NaOH溶液滴定待测H2SO4溶液的物质的量浓度
C.图3:将0.1mol/L 55mLNaOH溶液逐滴加入到0.1mol/L50mL盐酸溶液中测中和热
D.图4:模拟铁的腐蚀实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体,下列说法正确的是 ( )
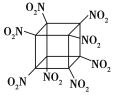
A. 分子中C、N间形成非极性键B. 1 mol该分子中含8 mol二氧化氮
C. 该物质既有氧化性又有还原性D. 该物质爆炸产物是NO2、CO2、H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com