
【题目】某有机物结构简式为: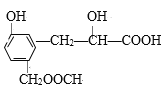 ,它可能发生的反应有:①加成反应;②取代反应;③还原反应;④水解反应;⑤中和反应;⑥显色反应;⑦氧化反应;⑧消去反应;其中正确的是( )
,它可能发生的反应有:①加成反应;②取代反应;③还原反应;④水解反应;⑤中和反应;⑥显色反应;⑦氧化反应;⑧消去反应;其中正确的是( )
A.③⑤⑥⑦B.全部C.④⑤⑥⑦D.除①④外其余都有
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题。
(1)氮、磷、砷的电负性的大小关系是 ,砷原子M层电子排布式为 。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为 ,该化学键能够形成的原因是 。
(3)已知:
CH4 | SiH4 | NH3 | PH3 | |
沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,沸点高低的原因是 。
② NH3和PH3比较,分解温度高低的原因是 。
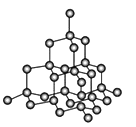
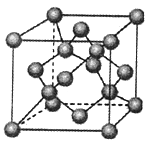
(4)金刚石是原子晶体,含有的最小环是六元环(如右边图),每个碳原子连接 个六元环,如左边图是金刚石的晶胞,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,碳原子在晶胞中的空间占有率 (不要求计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1L0.3mol L1HA溶液与0.1molNaOH固体混合,使之充分反应得到溶液(a)。然后向该溶液中通入HCl或加入NaOH固体(忽略体积和温度变化),溶液pH随通(加)入物质的量的变化如图。下列叙述错误的是

A. HA是一种弱酸
B. 向a点对应溶液中通入HCl,充分反应后,c(H+)/c(HA)增大
C. b点对应溶液中:c(Na+)=c(Cl-)>c(HA)>c(H+)>c(OH-)
D. c点对应溶液中:c(Na+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如图所示,其中B、D、E的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。请回答:
(1)A中所含官能团的名称为___;
(2)Ⅰ的反应类型为___(填字母序号),Ⅲ的反应类型为___;
a.取代反应 b.加成反应 c.氧化反应 d.消去反应
(3)D的分子式为___;
(4)写出下列反应的化学方程式:
Ⅰ:___;
Ⅱ:___;
III:C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为___;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个—CH3,写出其顺式结构的结构简式___;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
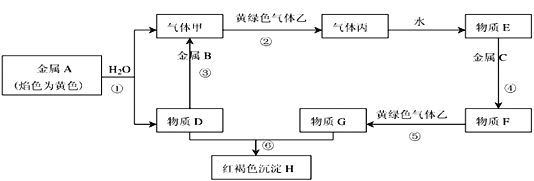
请回答下列问题:
(1)写出下列物质的化学式:丙_________、乙_________。
(2)图中反应①②③④⑤⑥中属于氧化还原反应的有:_____________________ ,属于置换反应反应的有:_______________ 。
(3)写出反应⑤的离子方程式:_____________________;
(4)写出反应①的化学方程式_______________________________ ,当得到标准状况 下的甲气体2.24L,则参加反应的金属A____________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
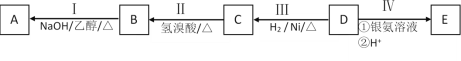
【题目】按以下步骤从![]() 合成
合成![]() (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)
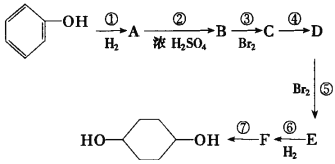
请回答下列问题:
(1)分别写出B、D的结构简式:B___、D___。
(2)反应①~⑦中属于消去反应的是___。(填数字代号)
(3)试写出C![]() D反应的化学方程式(有机物写结构简式,并注明反应条件)___。
D反应的化学方程式(有机物写结构简式,并注明反应条件)___。
(4)有机物X的产量是衡量一个国家石油化工发展水平的标志,请以X为原料经过四步反应合成乙酸乙酯___(无机试剂任选,请写出合成过程并注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:

回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:

①T℃时,该反应的平衡常数为_____________________(保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________________________________。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。

一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点是___,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:

已知以下信息:
①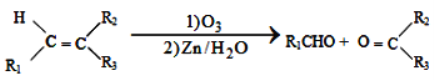
②1molB经上述反应可生成2molC,且C不能发生银镜反应。
③D属于单取代芳香烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的氢。
⑤
回答下列问题:
(1)由A生成B的化学方程式为_______________________。
(2)D的化学名称是______________________。
(3)G的结构简式为_______________________。
(4)F的同分异构体中含有苯环的还有____种(不考虑立体异构)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
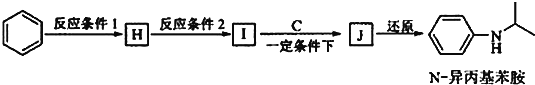
反应条件2所选用的试剂是_____________________, I的结构简式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
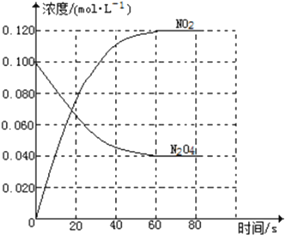
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com