
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:

已知以下信息:
①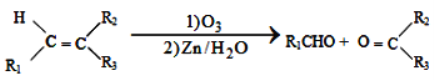
②1molB经上述反应可生成2molC,且C不能发生银镜反应。
③D属于单取代芳香烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的氢。
⑤
回答下列问题:
(1)由A生成B的化学方程式为_______________________。
(2)D的化学名称是______________________。
(3)G的结构简式为_______________________。
(4)F的同分异构体中含有苯环的还有____种(不考虑立体异构)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
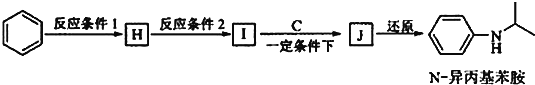
反应条件2所选用的试剂是_____________________, I的结构简式为___________________。
【答案】ClC(CH3)2CH(CH3)2+NaOH![]() (CH3)2C=C(CH3)2+NaCl+H2O 乙苯
(CH3)2C=C(CH3)2+NaCl+H2O 乙苯 ![]() 19 Fe/稀盐酸
19 Fe/稀盐酸 ![]()
【解析】
由A的分子式可知A为饱和一元卤代烃,由 知B中含有碳碳双键,根据
知B中含有碳碳双键,根据![]() ,1molB经上述反应可生成2molC,且C不能发生银镜反应,知A为(CH3)2CClCH(CH3)2.B为(CH3)2C=C(CH3)2,C为CO(CH3)2;由
,1molB经上述反应可生成2molC,且C不能发生银镜反应,知A为(CH3)2CClCH(CH3)2.B为(CH3)2C=C(CH3)2,C为CO(CH3)2;由![]() 知发生消去反应,D属于单取代芳香烃,其相对分子质量为106,所以D为乙苯,结构简式
知发生消去反应,D属于单取代芳香烃,其相对分子质量为106,所以D为乙苯,结构简式 由
由![]() 属于还原反应,核磁共振氢谱显示F苯环上有两种化学环境的氢,所以F为
属于还原反应,核磁共振氢谱显示F苯环上有两种化学环境的氢,所以F为![]() ,E为
,E为![]() ,C和F反应生成的G为
,C和F反应生成的G为![]() 。
。
(1)结合上述分析知A![]() B的化学方程式为:ClC(CH3)2CH(CH3)2+NaOH
B的化学方程式为:ClC(CH3)2CH(CH3)2+NaOH![]() (CH3)2C=C(CH3)2+NaCl+H2O。答案:ClC(CH3)2CH(CH3)2+NaOH
(CH3)2C=C(CH3)2+NaCl+H2O。答案:ClC(CH3)2CH(CH3)2+NaOH![]() CH3)2C=C(CH3)2+NaCl+H2O。
CH3)2C=C(CH3)2+NaCl+H2O。
(2)D的结构简式 ,所以D的化学名称是乙苯。答案:乙苯。
,所以D的化学名称是乙苯。答案:乙苯。
(3)G的结构简式为![]() 。
。
(4)由F的结构简式![]() 可知,它的同分异构体中含有苯环的还有邻乙基苯胺、间乙基苯胺;苯环上有2个甲基和1个氨基的共有6种;苯环上有1个甲基和1个甲胺基的有
可知,它的同分异构体中含有苯环的还有邻乙基苯胺、间乙基苯胺;苯环上有2个甲基和1个氨基的共有6种;苯环上有1个甲基和1个甲胺基的有![]() 及其邻、对位情况;苯环上有2个取代基的另一种情况是
及其邻、对位情况;苯环上有2个取代基的另一种情况是![]() 及其邻、对位情况;苯环上只有1个取代基的有
及其邻、对位情况;苯环上只有1个取代基的有![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() ,共19种.答案:19.
,共19种.答案:19.
(5)由苯与浓硝酸、浓硫酸在加热条件下得到的H为硝基苯,硝基苯在Fe/盐酸条件下还原得到的I为![]() ,再与(CH3)2C=O反应得到
,再与(CH3)2C=O反应得到![]() ,最后加成反应还原得到
,最后加成反应还原得到 。所以反应条件2所选用的试剂是Fe/稀盐酸, I的结构简式为
。所以反应条件2所选用的试剂是Fe/稀盐酸, I的结构简式为![]() 。答案:Fe/稀盐酸;
。答案:Fe/稀盐酸;![]() 。
。


科目:高中化学 来源: 题型:
【题目】下面是实验室制乙烯并检验其性质的装置图,请回答:

(1)写出圆底烧瓶中反应的方程式______________________________;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:____________________________________________;
(3)为了检验乙烯的生成及乙烯的不饱和性,试管中应盛放_________,现象为___________;
(4)洗瓶中盛放的试剂为____________________,作用__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是____(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料红氧化铁的工艺流程如下(部分操作和条件略):
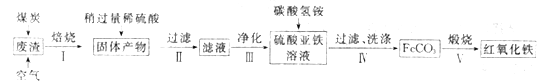
①在步骤Ⅰ中产生的有毒气体可能有_____________________。
②在步骤Ⅲ操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+ 沉淀完全,则溶液的pH为_________。(c(Al3+)≤1.0×10-5mol/L 视为Al3+沉淀完全)
③步骤Ⅳ中,生成FeCO3的离子方程式是____________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:__________________________________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应Ⅱ的离子方程式是____________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN-,方案如下:
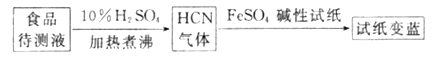
若试纸交蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)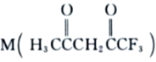 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgSO4·7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分其主要工艺如下:
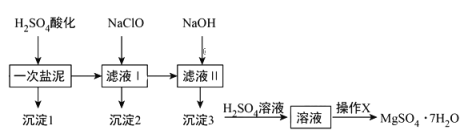
请回答下列问题:
(1)一次盐泥与H2SO4充分反应后,分离沉淀1与滤液I时所用到的玻璃仪器有玻璃棒和_____________.
(2)“操作X”是将溶液___________、___________、过滤洗涤,即得到MgSO4·7H2O晶体.
(3)加NaClO溶液至pH=5~6并加热煮沸5-10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为___________、___________;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为________.
(4)称量制得的样品5g,用200mL水溶解,加入2mol/L的盐酸5mL,在不断搅拌下滴加足量2mol/LBaCl2溶液,充分反应后,得沉淀4.66 g,则样品纯度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物与悬浮在大气中海盐粒子的相互反应:4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) ![]() 在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol,NO2的转化率为
在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol,NO2的转化率为![]() 。下列叙述中正确的是
。下列叙述中正确的是
A. 10min内NO浓度变化表示的速率υ(NO)=0.01mol·L-1·min-1
B. 若升高温度,平衡逆向移动,则该反应的![]()
C. 若起始时向该容器中充入0.1molNO2(g)、0.2molNO(g)和0.1molCl2(g)(固体物质足量),则反应将向逆反应方向进行
D. 若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装量制取少量澳苯并证明该反应是取代反应。请回答:
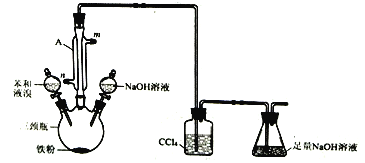
(1)仪器A的名称为____________,冷凝水的进水口为_________,(填“m”或“n”)。
(2)制取溴苯的化学方程式为___________________。
(3)锥形瓶中足量NaOH溶液的作用是_________。
(4)从实验安全的角度分析,该实验装置存在一处明显的缺陷请指出_________。
(5)反应结束后向三颈瓶中滴加氢氧化钠溶液,充分振荡,然后用__________(填仪器名称)分离出溴苯(仍含有少量苯)。
(6)设计实验证明制取溴苯的反应是取代反应___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol·L-1的CH3NH2和1mol·L-1的NH2OH(NH2OH+H2O![]() NH3OH++OHˉ)两种碱溶液,起始时的体积均为10mL,分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lgc(OH-)。下列说法正确的是
NH3OH++OHˉ)两种碱溶液,起始时的体积均为10mL,分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lgc(OH-)。下列说法正确的是

A. NH2OH的电离常数K的数量级为10-8
B. CH3NH3Cl盐溶液中水解离子方程式为:CH3NH2+H2O![]() CH3NH3++OH-
CH3NH3++OH-
C. 当两溶液均稀释至lg![]() =4时,溶液中水的电离程度:NH2OH >CH3NH2
=4时,溶液中水的电离程度:NH2OH >CH3NH2
D. 浓度相同的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系:c(CH3NH3+)<c(NH3OH+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体 ②KHSO4 ③HNO3 ④稀硫酸 ⑤二氧化碳气体 ⑥铜 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是____________________________________。
(2)属于电解质的是__________________________________________。
(3)属于非电解质的是____________________________________。
(4)②在水溶液中的电离方程式为_____________________,①与②在溶液中反应使溶液呈中性的离子方程式为______________________________________________。
(5)③与⑥可以发生如下反应:Cu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
I.还原产物是________。
II.当有2 mol HNO3参加反应时,被氧化的物质的质量为________g。
Ⅲ.用单线桥法标出反应中电子转移的方向和数目________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com