
【题目】下面是实验室制乙烯并检验其性质的装置图,请回答:

(1)写出圆底烧瓶中反应的方程式______________________________;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:____________________________________________;
(3)为了检验乙烯的生成及乙烯的不饱和性,试管中应盛放_________,现象为___________;
(4)洗瓶中盛放的试剂为____________________,作用__________________.
【答案】CH3CH2OH ![]() CH2=CH2↑+H2O C + 2H2SO4
CH2=CH2↑+H2O C + 2H2SO4![]() CO2↑+2SO2↑ +2H2O 溴水(或溴的CCl4溶液) 溴水(或溴的CCl4溶液)褪色 NaOH溶液 除去乙烯中混有的SO2、CO2等气体
CO2↑+2SO2↑ +2H2O 溴水(或溴的CCl4溶液) 溴水(或溴的CCl4溶液)褪色 NaOH溶液 除去乙烯中混有的SO2、CO2等气体
【解析】
(1)实验室制乙烯常用乙醇在170℃消去制备乙烯,其化学方程式为CH3CH2OH ![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
(2)持续加热,乙醇会被浓硫酸碳化,生成的C与浓硫酸在高温下发生氧化还原反应生成CO2和SO2,化学方程式为C + 2H2SO4![]() CO2↑+ 2SO2↑ +2H2O。
CO2↑+ 2SO2↑ +2H2O。
(3)为了检验乙烯的生成及乙烯的不饱和性,试管中应盛放溴水(或溴的CCl4溶液),现象为溴水(或溴的CCl4溶液)褪色。
(4)由于反应中产生SO2和CO2,尤其是SO2可以与溴水反应,方程式为SO2+Br2+2H2O=H2SO4+2HBr,也能使溴水褪色,另外值得注意SO2不和溴的CCl4溶液反应,原因溴氧化SO2需要水的参与。所以洗瓶中盛装如NaOH溶液,作用是除掉SO2和CO2,同时也可以溶解乙醇蒸汽。


科目:高中化学 来源: 题型:
【题目】H2S的分解反应是一个可逆反应,其能量与反应进程的关系如图所示,下列有关说法正确的是( )

A. 正反应的活化能大于逆反应的活化能
B. 若减小体系的压强,则该反应的焓变将增大
C. 升高温度,化学反应速率加快,H2S的平衡转化率减小
D. 向密闭容器中充入1molH2S充分反应,吸收84.9kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示,则下列结论正确的是

A. 容器中发生的反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应进行的前3min内,用X表示的反应速率v(X)=0.2 mol·L-1·min-1
C. 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D. 保持其他条件不变,升高溫度,反应的化学平衡常数K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究煤的合理利用及CO2的综合应用有着重要的意义。请回答以下问题:
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
C(s)+H20(g)![]() CO(g)+H2(g) △H=+131kJ/mol
CO(g)+H2(g) △H=+131kJ/mol
②CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H=akJ/mol
CH4(g)+H2O(g) △H=akJ/mol
查阅资料反应②中相关化学键键能数据如下表:
化学键 |
| H-H | H—C | H-O |
E/(kJ/mol) | 1072 | 436 | 414 | 465 |
(1)煤直接甲烷化反应C(s)+2H2(g)![]() CH4(g)的△H为_______kJ/mol,该反应在______(填“髙温”或“低温”)下自发进行。
CH4(g)的△H为_______kJ/mol,该反应在______(填“髙温”或“低温”)下自发进行。
Ⅱ.合成低碳烯烃
在体积为1 L的密闭容器中,充入1molCO2和2.5molH2,发生反应:
2C02(g)+6H2(g)![]() C2H4(g)+4H20(g) △H=-128kJ/mol,测得温度对催化剂催化效率和 C02平衡转化率的影响如图所示:
C2H4(g)+4H20(g) △H=-128kJ/mol,测得温度对催化剂催化效率和 C02平衡转化率的影响如图所示:
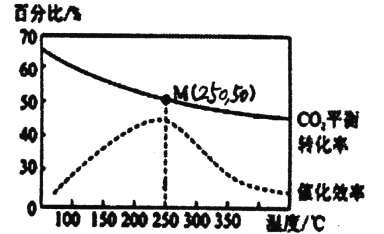
(2)图中低温时,随着温度升高催化剂的催化效率提高,但C02的平衡转化率却反而降低,其原因是__________。
(3)250℃时,该反应的平衡常数K值为__________。
Ⅲ.合成甲醇
在恒温2 L容积不变的密闭容器中,充入lmolC02和3molH2,发生反应:C02(g)+3H2(g)![]() CH30H(g)+H20(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH30H(g)+H20(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(4)反应前1小时内的平均反应速率V(H2)为_________mol/(L·h),该温度下C02的平衡转化率为_________。
IV.电解逆转化制乙醇
(5)科研人员通过反复实验发现:C02可以在酸性水溶液中电解生成乙醇,则生成乙醇的反应发生在_________极(“阴”或“阳”),该电极的反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
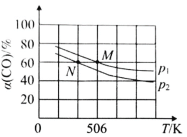
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:KClO3+H2C2O4+H2SO4![]() ClO2↑+K2SO4+CO2↑+H2O(未配平)下列说法正确的是
ClO2↑+K2SO4+CO2↑+H2O(未配平)下列说法正确的是
A.KClO3在反应中得到电子B.ClO2是氧化产物
C.H2C2O4在反应中被还原D.1 mol KClO3参加反应有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2、ZnC2、Al4C3、Mg2C3、Li2C2等同属于离子型碳化物,请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
A. Mg2C3水解生成丙炔B. Al4C3水解生成丙炔
C. ZnC2水解生成乙烷D. Li2C2水解生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合肥市某高中化学非限定性课程学习小组利用铁锈(Fe2O3)做了系列实验,物质之间的关系图如下。
根据所学知识回答以下问题:
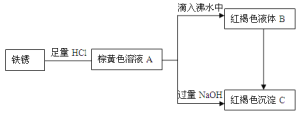
IHCl的配制
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制480mL0.1mol/L的盐酸溶液。
(1)配制480mL0.1mol/L的盐酸溶液需要浓盐酸的体积为___mL。(保留2位有效数字)
(2)除了烧杯、玻璃棒、量筒、胶头滴管和试剂瓶还需要的仪器有___。
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏低”或“偏高”)
未洗涤烧杯___;定容时俯视刻线____。
II探究实验
(1)写出由A滴入到沸水中制备B的化学方程式。___
(2)下列说法正确的有___(填序号)。
①B转换成C发生了化学反应
②由A制备B,加热越久越好
③物质B具有丁达尔效应
④把B和C组成的混合物过滤,滤液是无色的
⑤整个过程都不涉及到氧化还原反应
(3)向红褐色沉淀C中加入NaClO和NaOH混合溶液,生成一种高效杀菌净水剂Na2FeO4,已知每生成0.2mol的Na2FeO4消耗0.3molNaClO,则该反应的还原产物为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:

已知以下信息:
①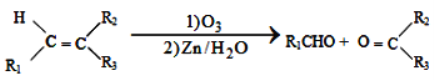
②1molB经上述反应可生成2molC,且C不能发生银镜反应。
③D属于单取代芳香烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的氢。
⑤
回答下列问题:
(1)由A生成B的化学方程式为_______________________。
(2)D的化学名称是______________________。
(3)G的结构简式为_______________________。
(4)F的同分异构体中含有苯环的还有____种(不考虑立体异构)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
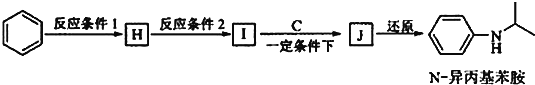
反应条件2所选用的试剂是_____________________, I的结构简式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com